TEORÍA DE LEWIS SOBRE EL ENLACE COVALENTE

En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce por compartición de pares de electrones, mecanismo por el que cada átomo individualmente podría alcanzar ocho electrones en su capa más externa.
El fundamento de este principio hay que buscarlo en dos descubrimientos realizados a principios del siglo XX:
- El comportamiento químico de los elementos estaba relacionado con el número de electrones en la capa de valencia, es decir, en la capa más externa.
- Los gases nobles muestran una notable inercia química y ocho electrones en su capa de valencia.
La propuesta de Lewis indica que los átomos se unen para formar moléculas compartiendo electrones ya que de esa forma pueden llegar a tener ocho electrones en sus capas de valencia
Ejemplo: Formación de la molécula de cloro
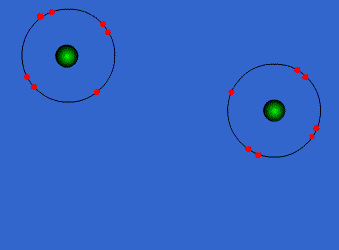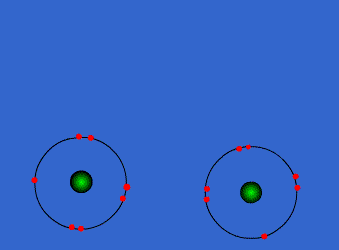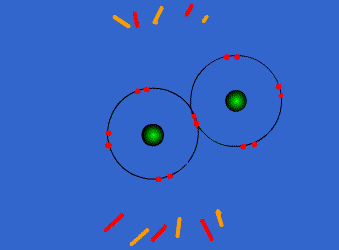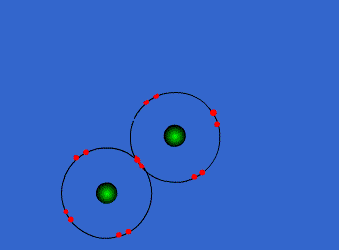
Por separado, cada átomo de cloro tiene 7 electrones en su corteza electrónica. Sin embargo, cuando se acercan y comparten un par de electrones, cada uno de ellos llega a tener 8 electrones en su capa de valencia (siete propios y uno del otro átomo). Este hecho se mantendrá en el tiempo siempre que la molécula Cl2 se mantenga unida.
En consecuencia, según Lewis, el átomo Cl es más estable dentro de la molécula Cl2 que aislado
El aumento de estabilidad que se observa al formarse la molécula tiene explicación en base a los cambios de energía que se producen cuando los átomos se aproximan desde el infinito hasta la distancia de enlace. Cuando eso ocurre, la energía potencial del sistema formado por los dos átomos disminuye y alcanza un mínimo precisamente cuando están a la distancia de enlace, es decir, formando la molécula.
COMPRUÉBELO CON LA SIGUIENTE SIMULACIÓN
SÍMBOLOS DE LEWIS

Los símbolos de Lewis se construyen a partir del símbolo del elemento rodeándolo de tantos puntos como electrones de valencia posea.
Los metales alcalinos son los elementos que tienen el número más pequeño de electrones de valencia. Por el contrario, los gases nobles, con ocho, son los que tienen una capa de valencia más poblada.
ENLACES MÚLTIPLES
La Teoría de Lewis explica la formación de enlaces múltiples. Mientras que los enlaces covalentes sencillos se forman por la compartición de un par de electrones, los enlaces covalentes dobles o triples se forman por la compartición de dos o tres pares.
