ESTRUCTURA MOLECULAR
TEORÍA DEL ENLACE DE VALENCIA
HIBRIDACIÓN
LA TEORÍA DEL ENLACE DE VALENCIA SE FORMULA EN 1927. ES EL RESULTADO DE LOS ESTUDIOS DE WALTER HEITLER Y FRITZ LONDON Y SUPONE EL PRIMER ÉXITO DE LA APLICACIÓN DE LA ECUACIÓN DE SCHRODINGER EN LA EXPLICACIÓN DE LA FORMACIÓN DE UNA MOLÉCULA (DIHIDRÓGENO). SIN EMBARGO, EL ÉXITO DE ESTA TEORÍA NO HABRÍA SIDO COMPLETO SIN QUE LINUS PAULING INTRODUJERA LOS CONCEPTOS DE HIBRIDACIÓN Y DE RESONANCIA (1928-1930).



Walter Heitler ------------------------ Fritz London ------------------- Linus Pauling
LOS SUPUESTOS DE LA TEORÍA DEL ENLACE DE VALENCIA SE PUEDEN RESUMIR DE LA SIGUIENTE MANERA:
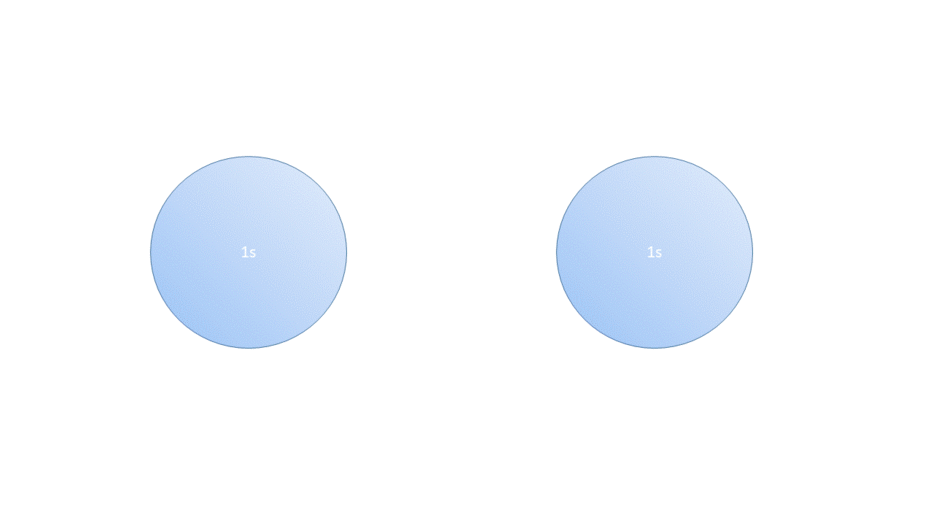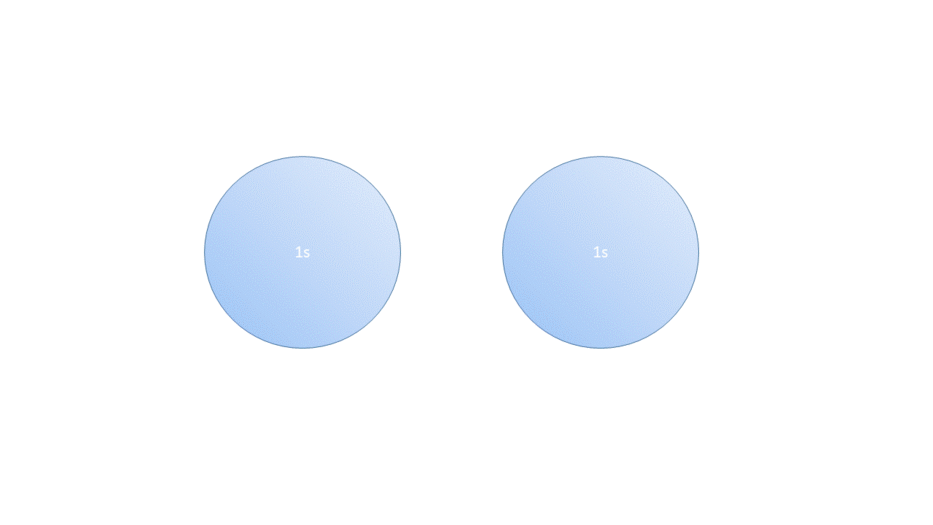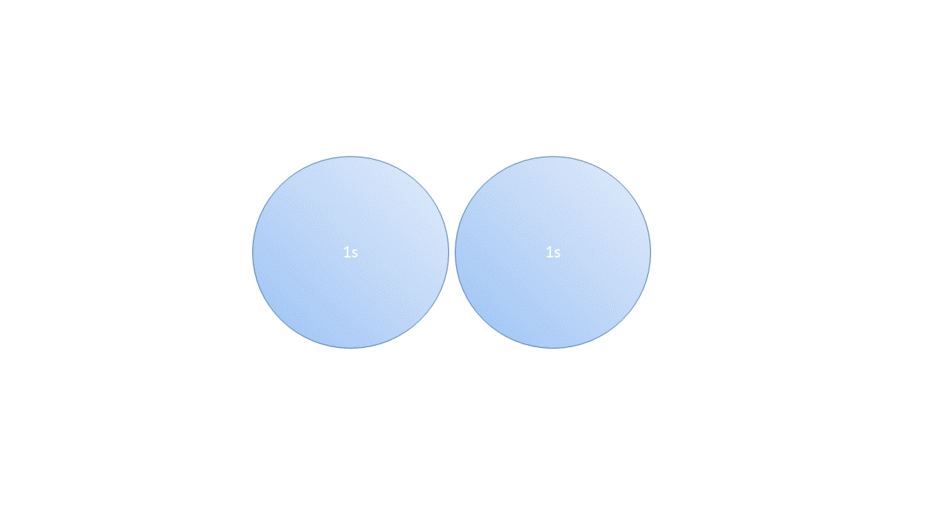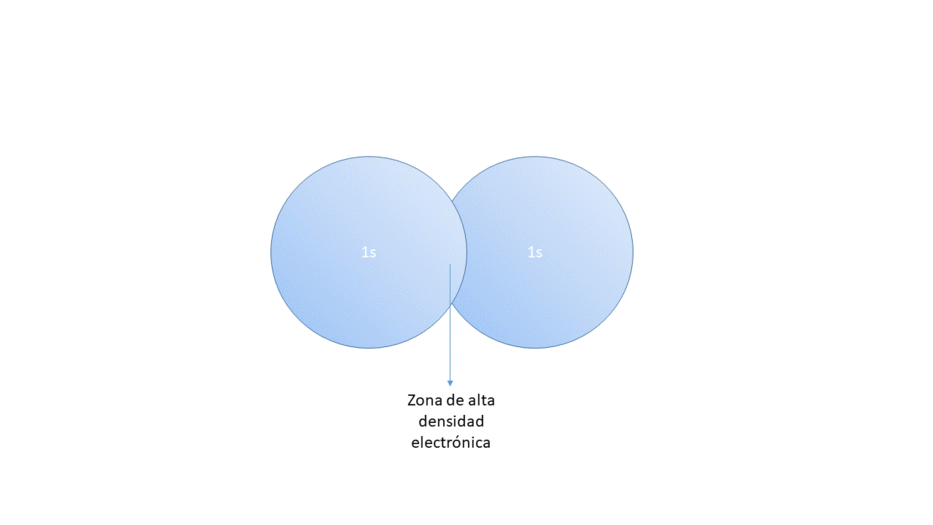
1.- LOS ENLACES COVALENTES SE PRODUCEN POR SOLAPAMIENTO DE ORBITALES ATÓMICOS SEMIOCUPADOS
La aproximación de ambos orbitales da lugar a una zona de alta densidad electrónica entre los núcleos que forma la molécula
2.- EL SOLAPAMIENTO DE ORBITALES ATÓMICOS SE PUEDE REALIZAR DE DOS FORMAS:
FRONTALMENTE (DA LUGAR A UN ENLACE TIPO σ)
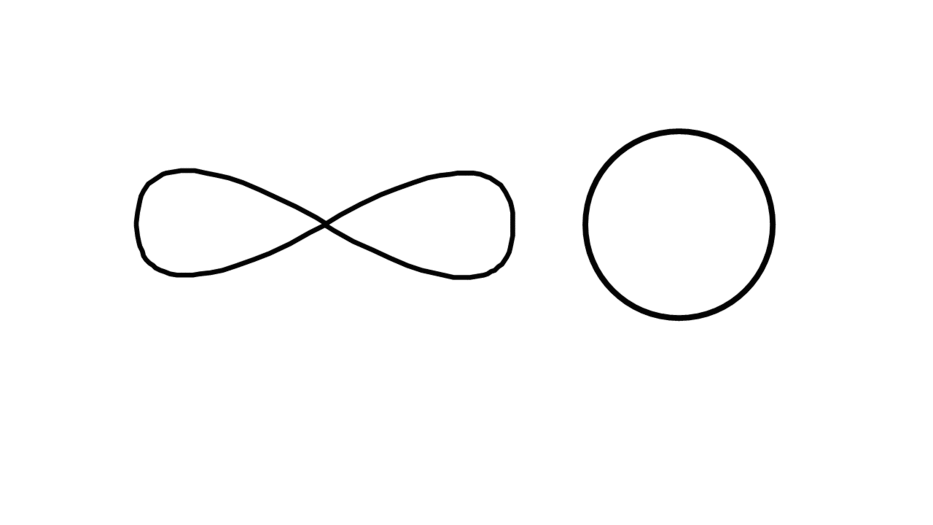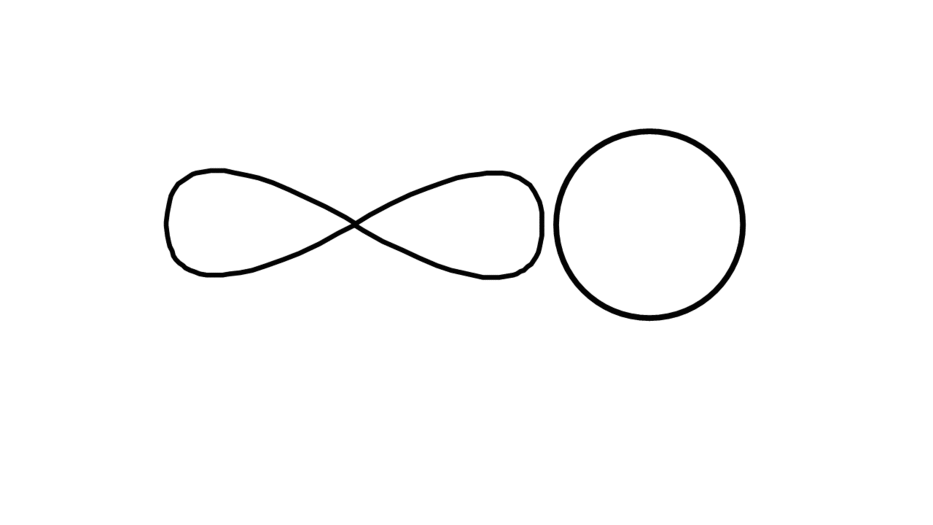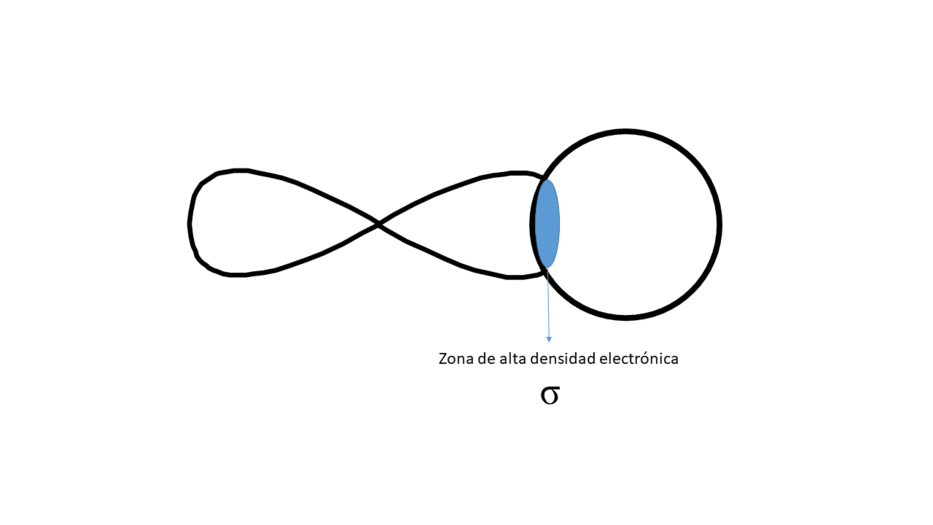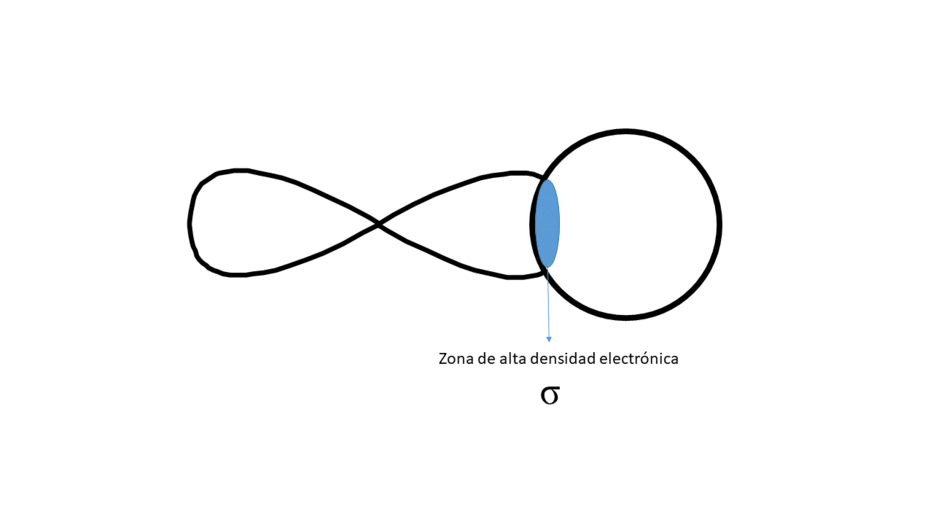
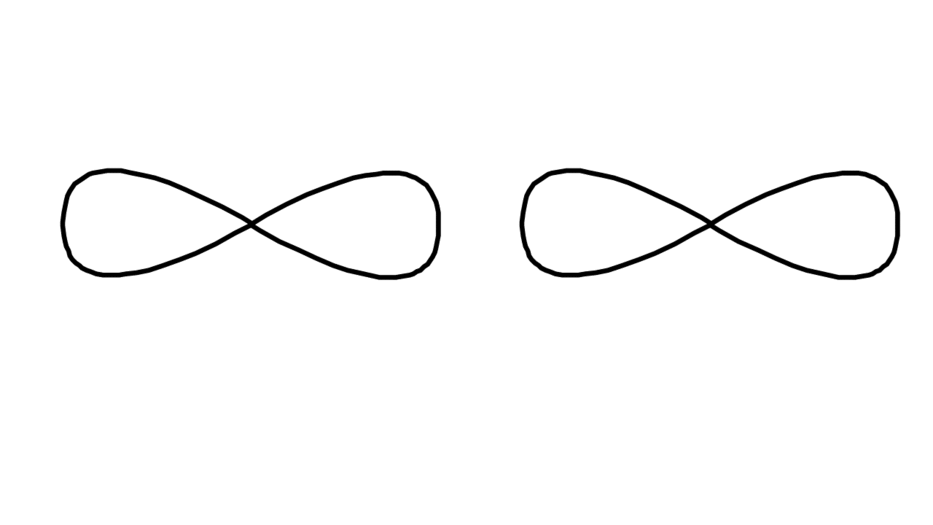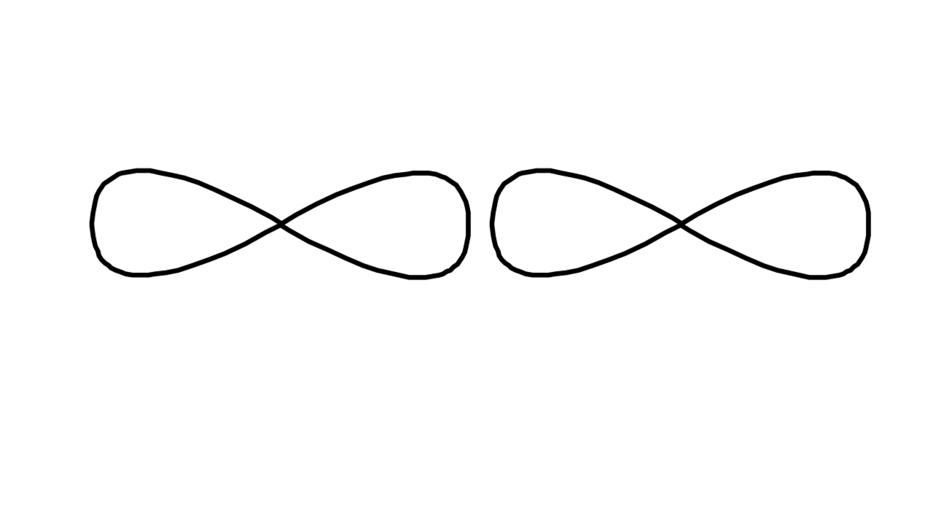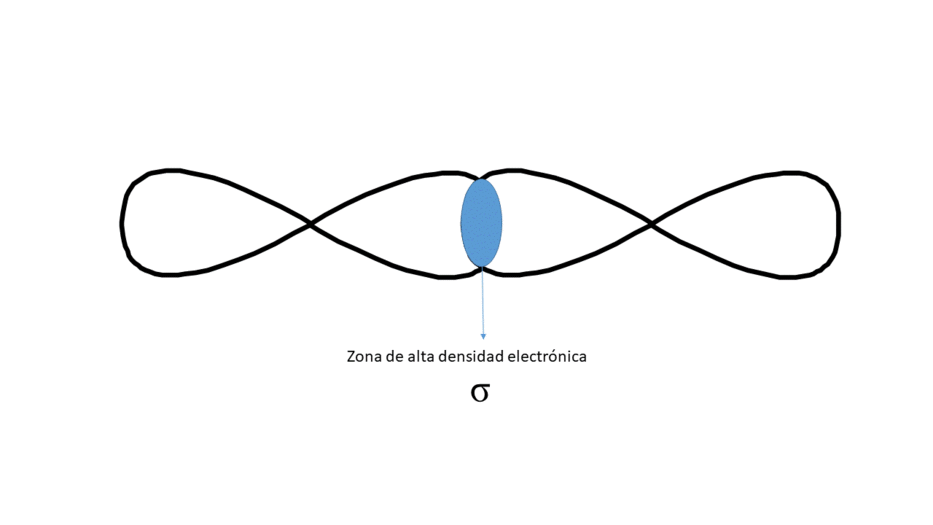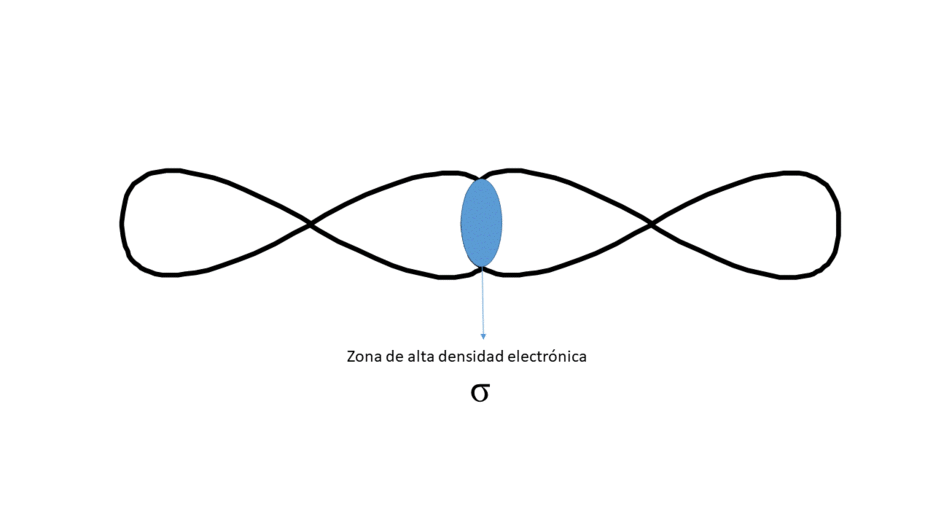
Entre los núcleos solo hay una zona central de alta densidad electrónica
LATERALMENTE (DA LUGAR A UN ENLACE TIPO π).
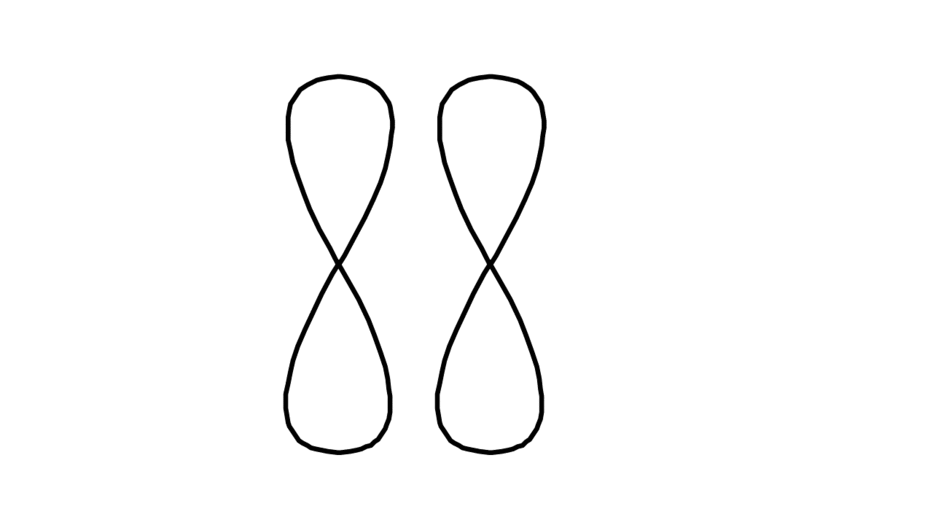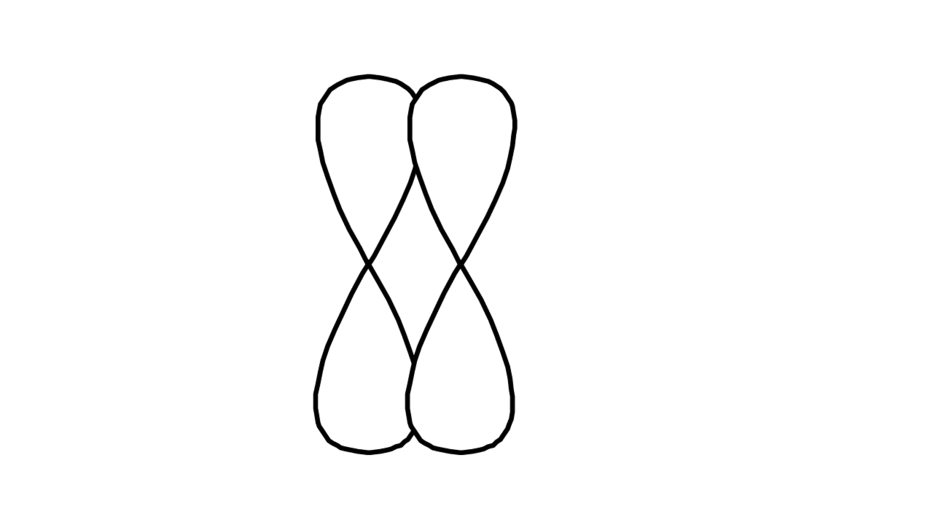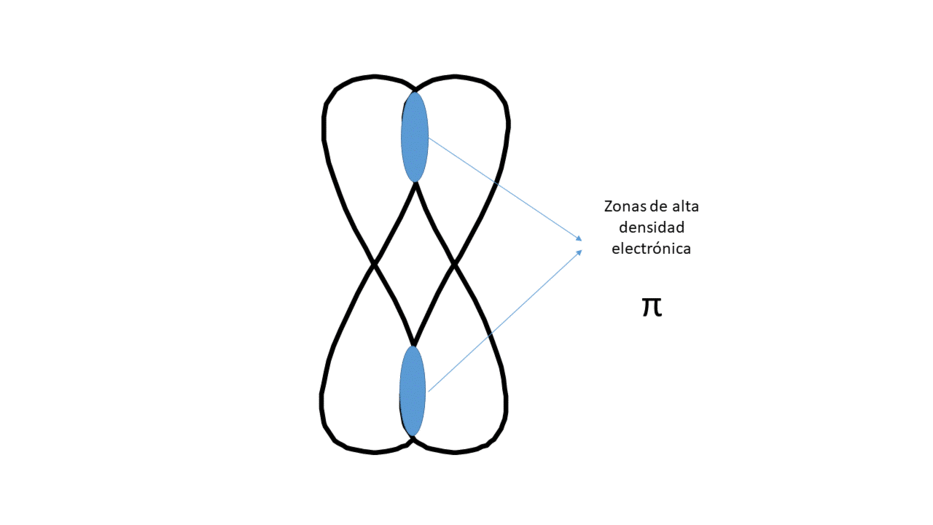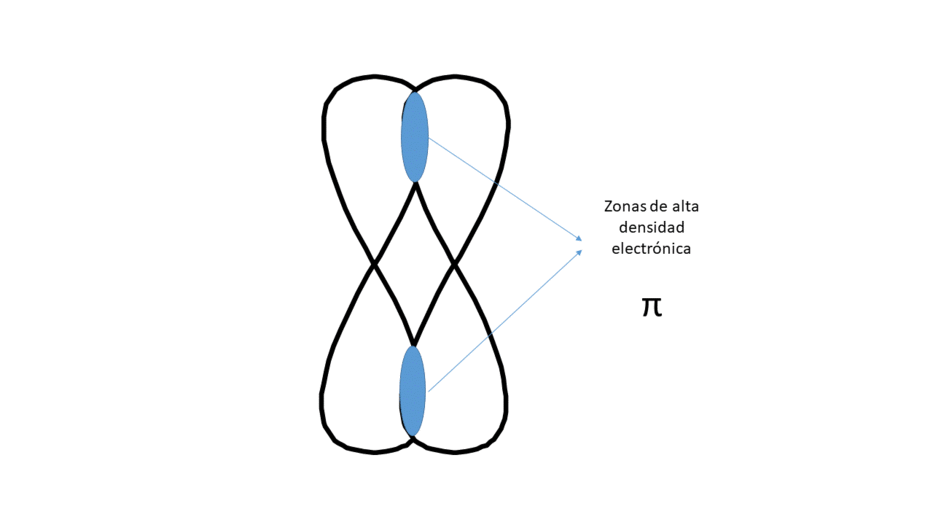
Entre los núcleos hay dos zonas (no centradas) de alta densidad electrónica
3.- ANTES DEL SOLAPAMIENTO, LOS ORBITALES ATÓMICOS PUEDEN SUFRIR HIBRIDACIÓN, DANDO LUGAR A NUEVOS ORBITALES ATÓMICOS HÍBRIDOS
