

ENLACE COVALENTE
TEORÍA DEL ENLACE-VALENCIA E HIBRIDACIÓN
TEORÍA DEL ENLACE-VALENCIA


Heitler y London
En 1927 Walter Heitler y Fritz London desarrollaron un modelo mecanocuántico de la molécula de hidrógeno. La idea básica era que el enlace covalente se podía formar por el solapamiento de orbitales atómicos semiocupados. Poco después, en 1931, Linus Pauling complementó esta teoría con la teoría de la hibridación de orbitales.

Linus Pauling
LOS SUPUESTOS DE LA TEORÍA DEL ENLACE DE VALENCIA SE PUEDEN RESUMIR DE LA SIGUIENTE MANERA:
1.- LOS ENLACES COVALENTES SE PRODUCEN POR SOLAPAMIENTO DE ORBITALES ATÓMICOS SEMIOCUPADOS
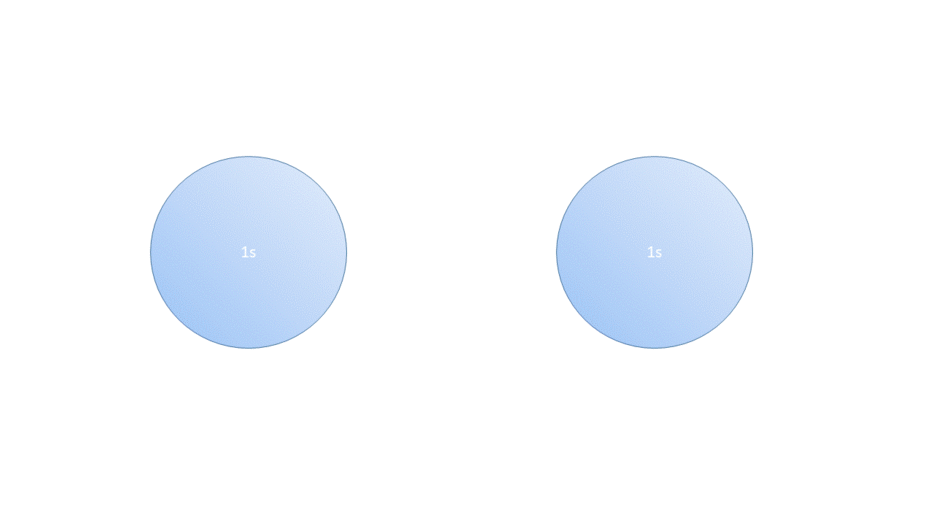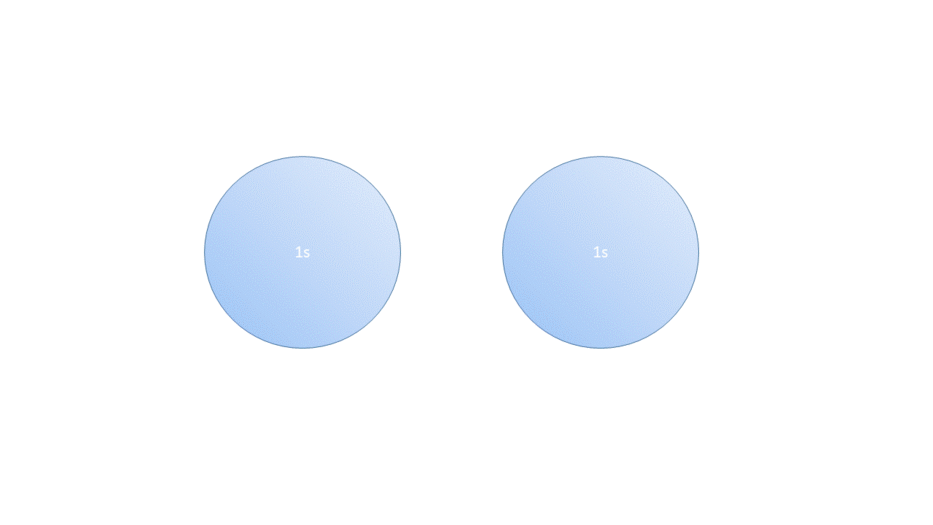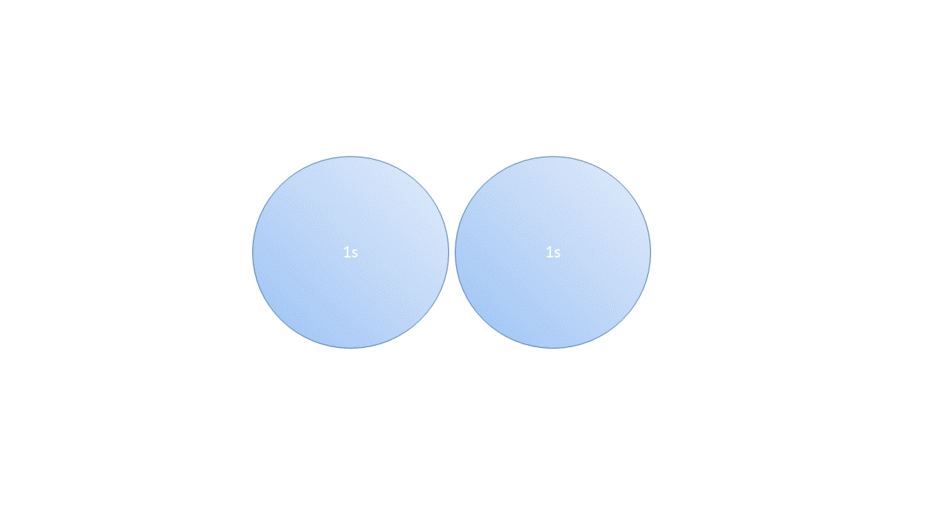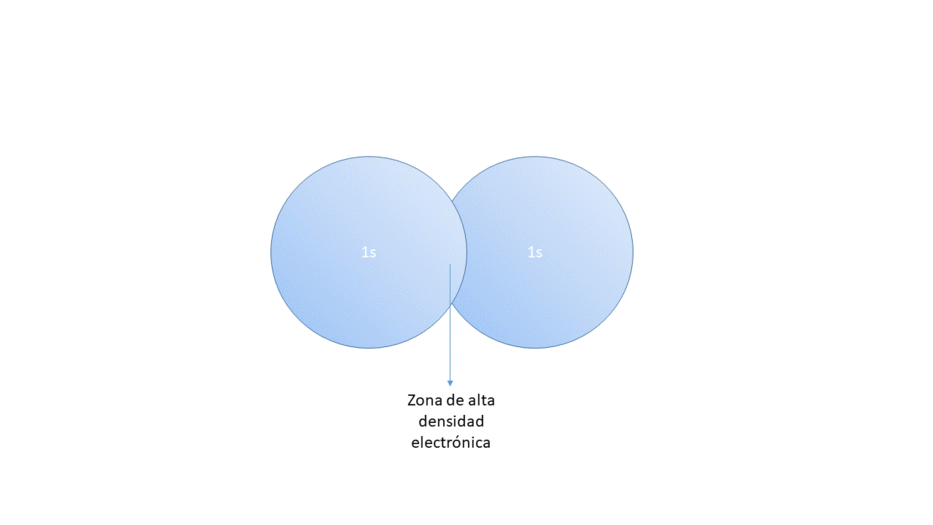

La aproximación de ambos orbitales da lugar a una zona de alta densidad electrónica entre los núcleos que forma la molécula

2.- EL SOLAPAMIENTO DE ORBITALES ATÓMICOS SE PUEDE REALIZAR DE DOS FORMAS:
Frontalmente (Da lugar a un enlace tipo σ)
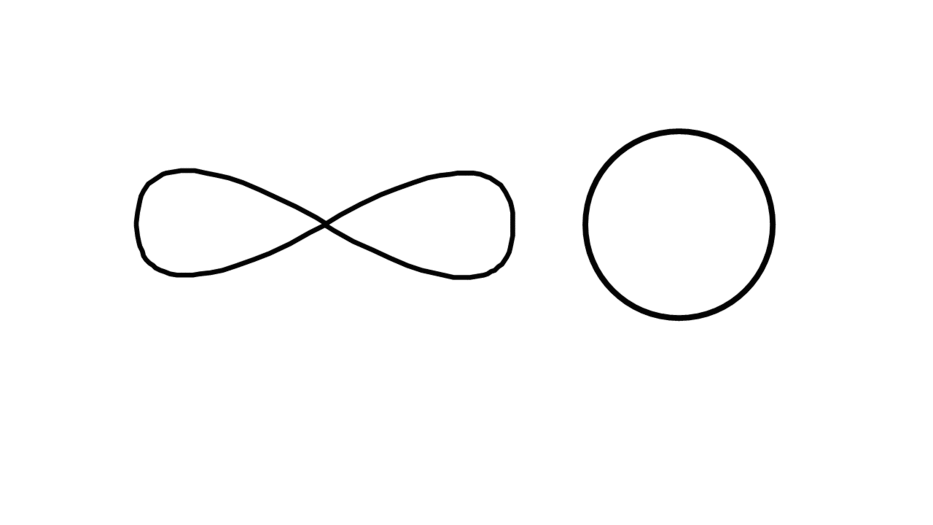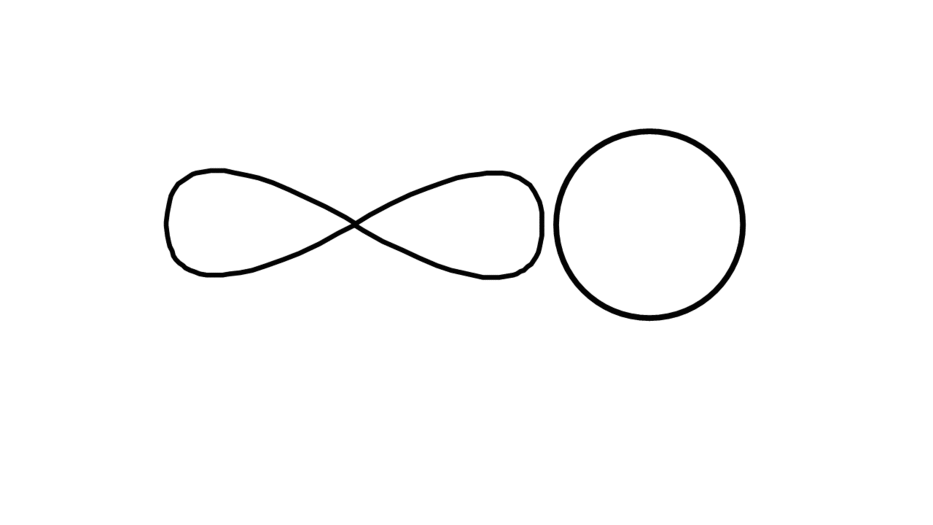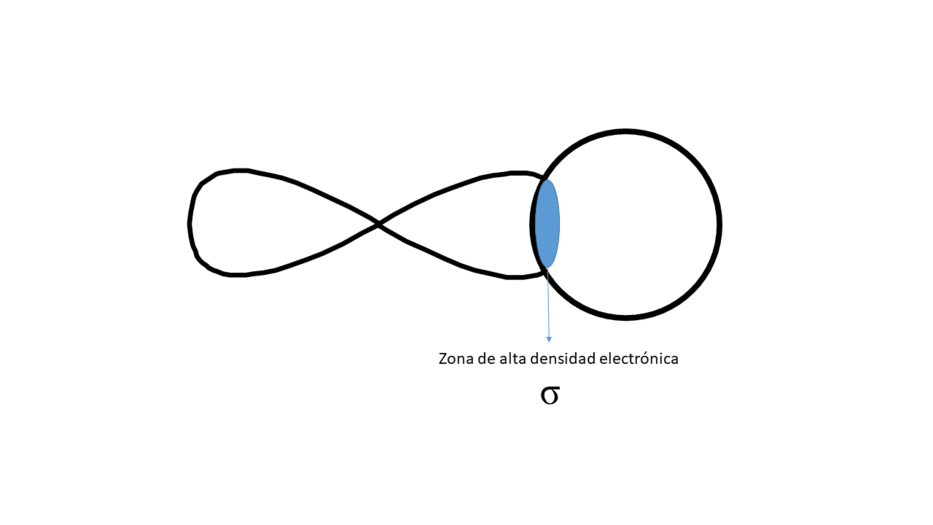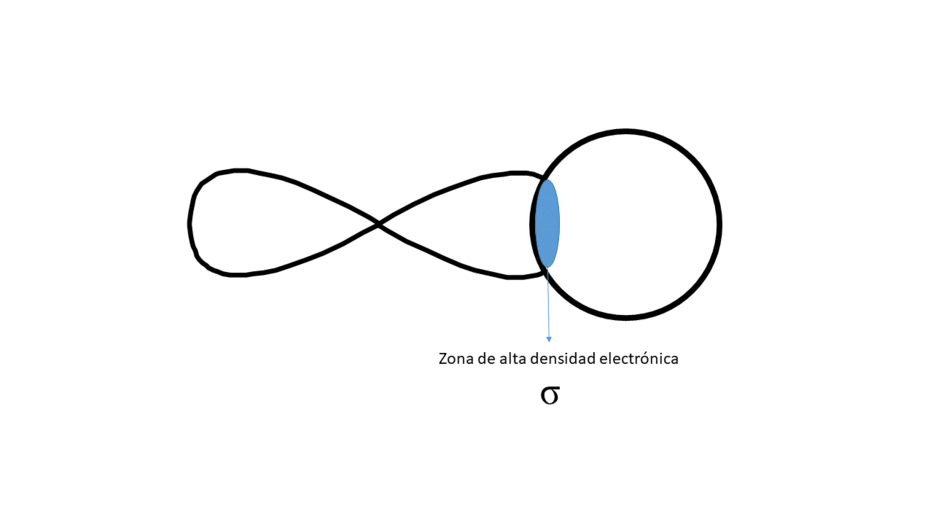
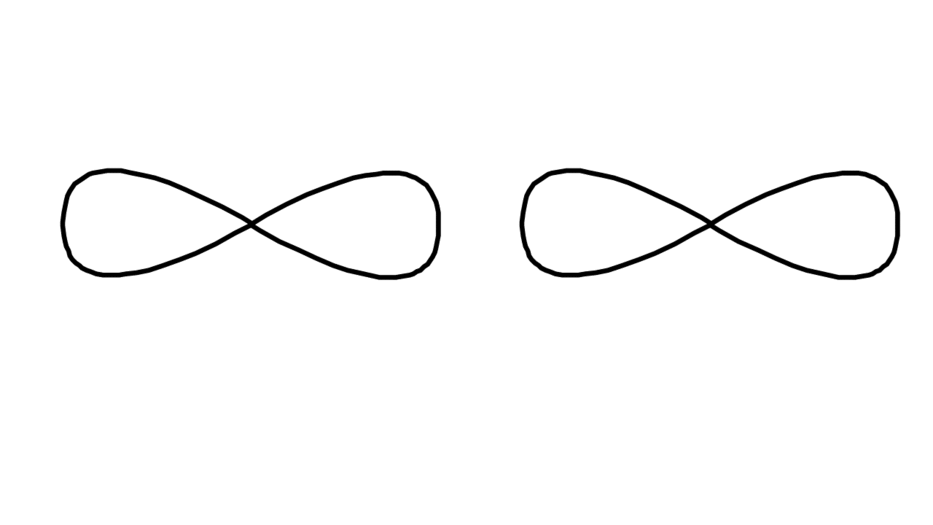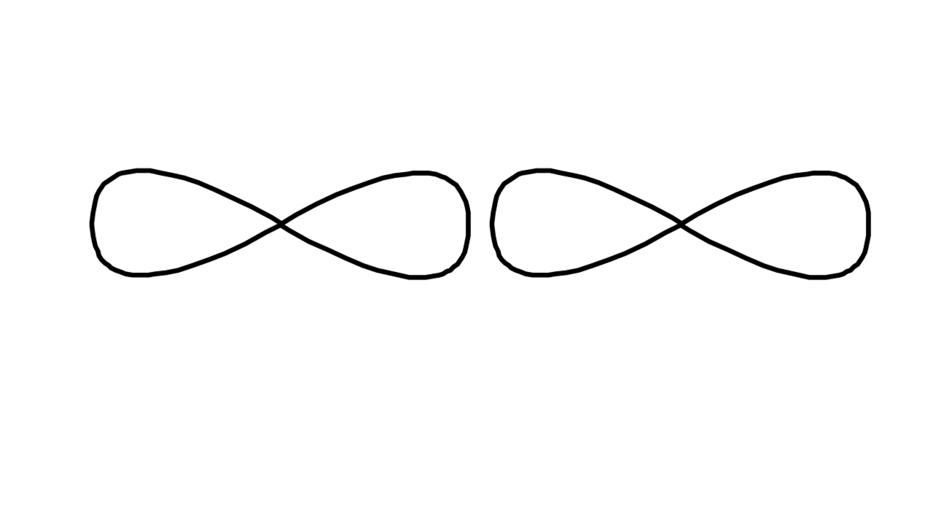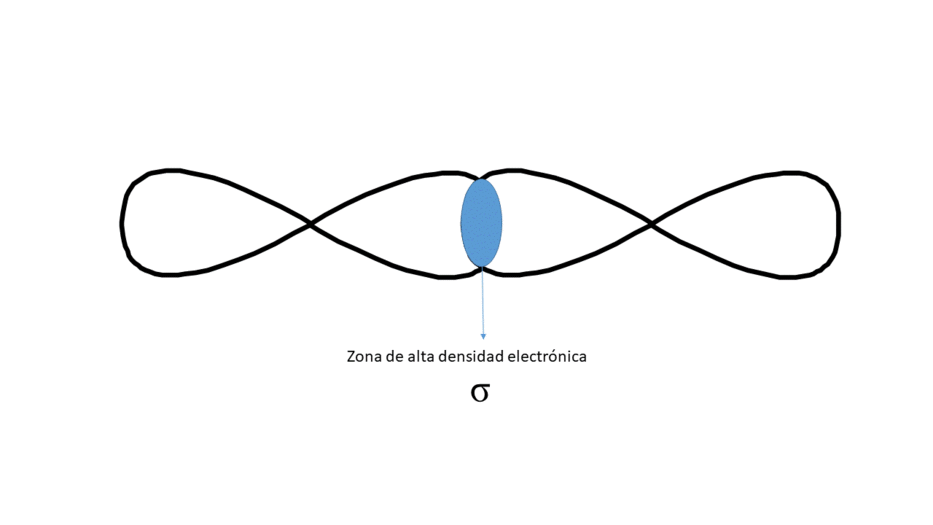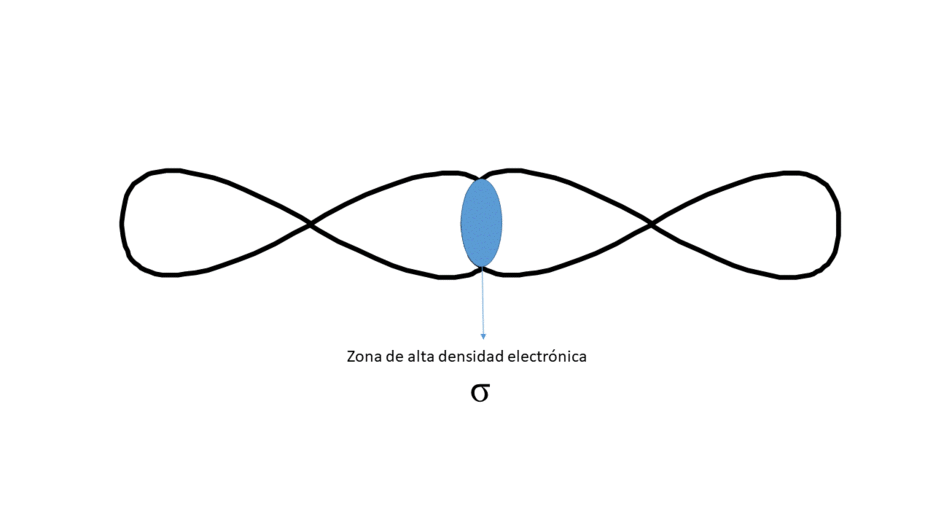
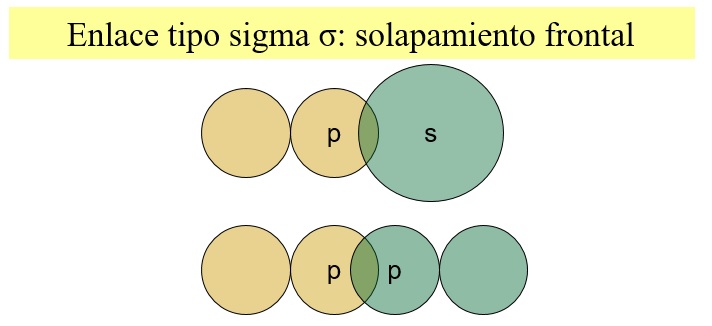
Entre los núcleos solo hay una zona central de alta densidad electrónica
Lateralmente (Da lugar a un enlace tipo π)
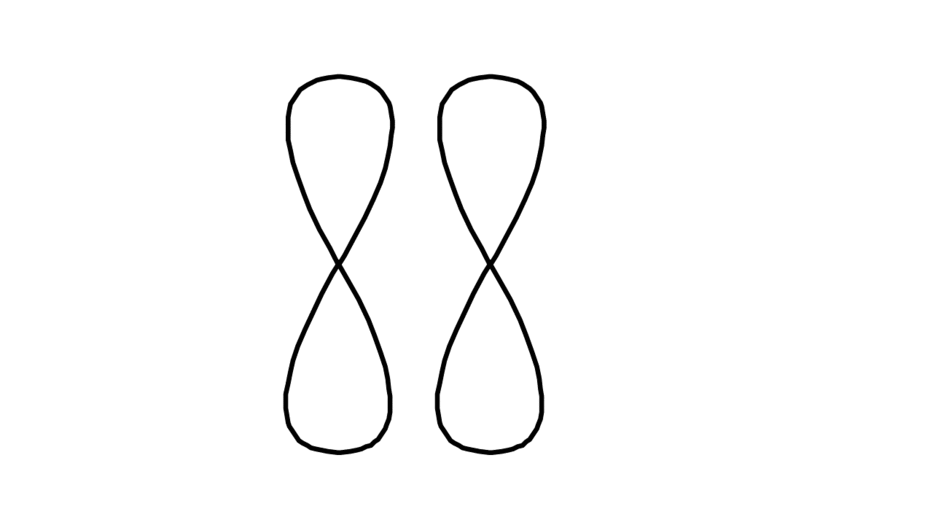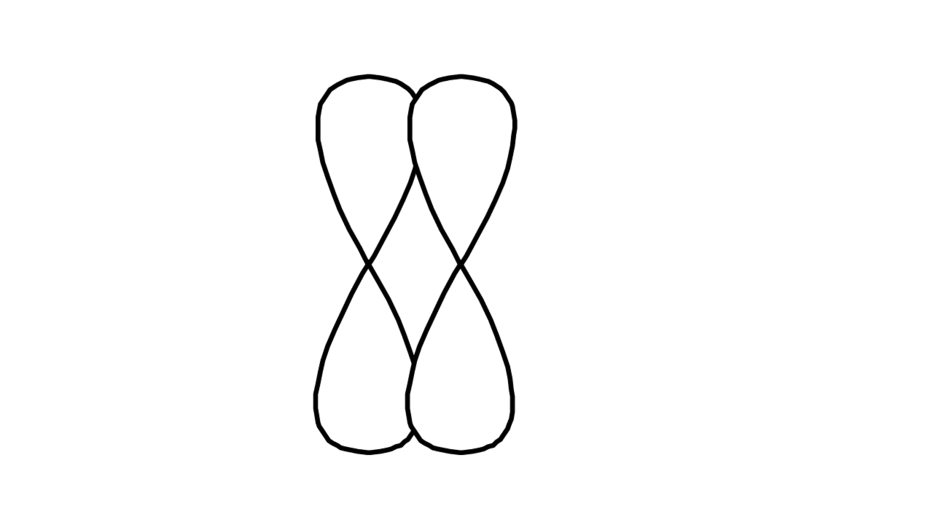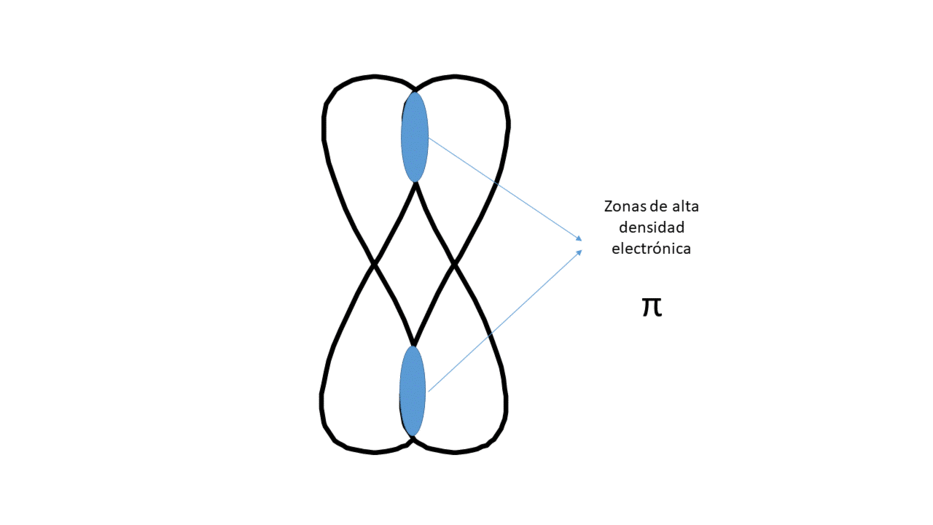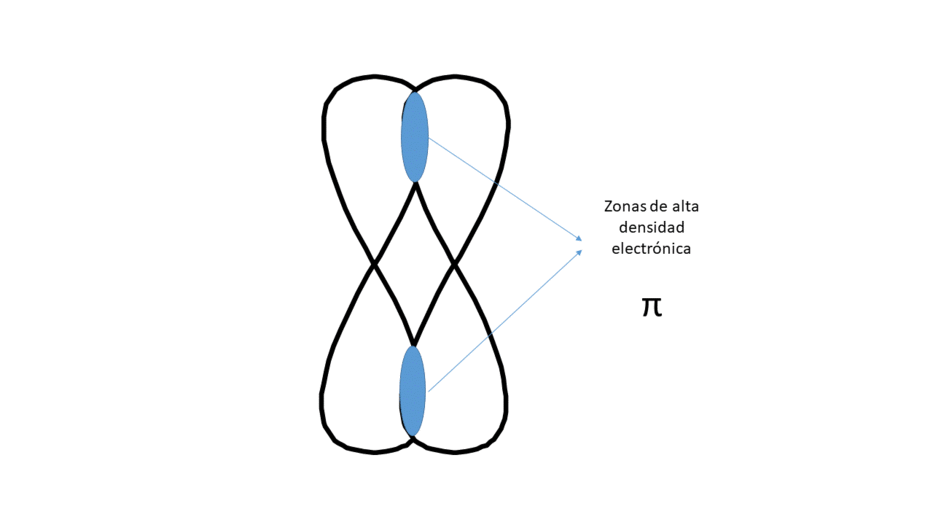
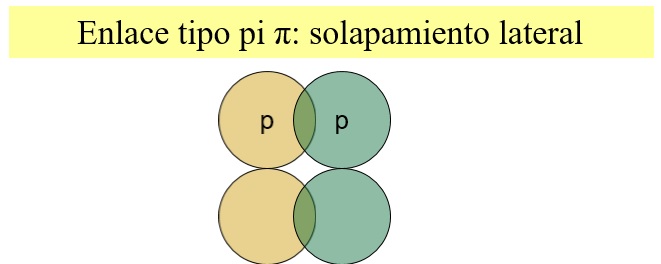
Entre los núcleos hay dos zonas (no centradas) de alta densidad electrónica
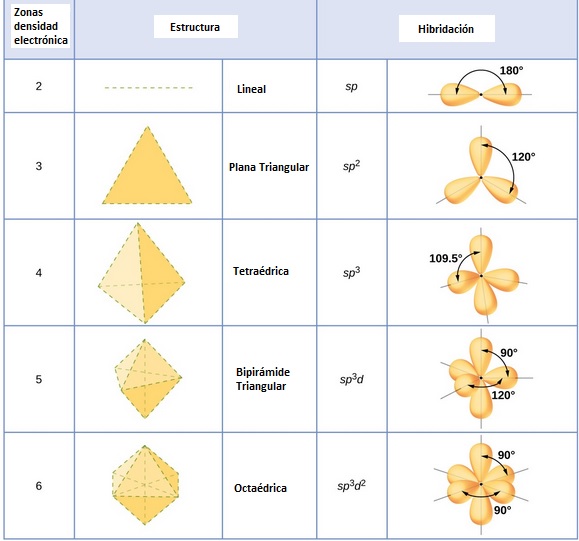
3.- ANTES DEL SOLAPAMIENTO, LOS ORBITALES ATÓMICOS PUEDEN SUFRIR HIBRIDACIÓN, DANDO LUGAR A NUEVOS ORBITALES ATÓMICOS HÍBRIDOS

LA HIBRIDACIONES MÁS COMUNES SON LAS SIGUIENTES:
Hibridación sp : Un orbital s se hibrida con un orbital p dando lugar a dos orbitales híbridos sp. El ángulo entre ellos es de 180 º
(LINEAL)
Hibridación sp2 : Un orbital s se hibrida con dos orbitales p dando lugar a tres orbitales híbridos sp2. El ángulo entre ellos es de 120 º
(PLANA TRIANGULAR)
Hibridación sp3 : Un orbital s se hibrida con tres orbitales p dando lugar a cuatro orbitales híbridos sp3. El ángulo entre ellos es de 109,5 º
(TETRAÉDRICA)
En la siguiente web podrá visualizar la formación y geometría de los orbitales híbridos. En ella encontrará casos de hibridación que involucran a los orbitales tipo d.
ESSENTIALCHEMISTRY
INDICE
- Teorías acerca del enlace químico
- Estudio energético de la formación del enlace iónico. Energía reticular
-Teoría del enlace-valencia y Hibridación
- Energía de disociación de enlace
HIBRIDACIÓN

Practicando hibridación con Science Geek.Net
HIBRIDACIÓN sp3
HIDROCARBUROS ALCANOS
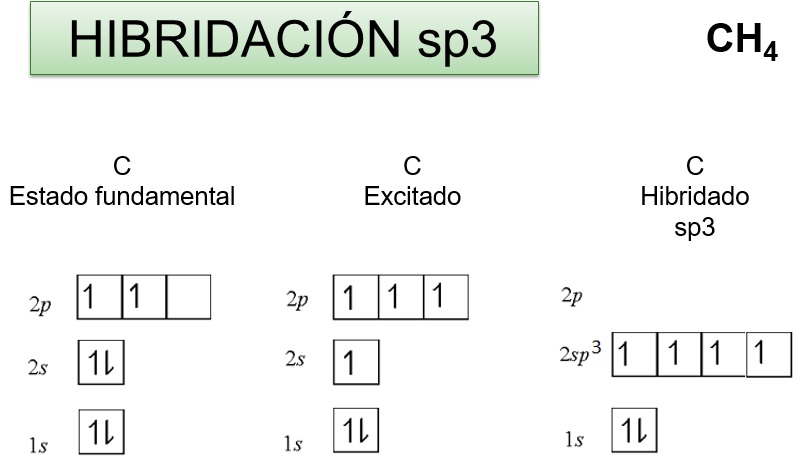
EN LOS ALCANOS EL CARBONO CENTRAL ESTÁ RODEADO DE CUATRO GRUPOS ELECTRÓNICOS QUE PARTICIPAN EN ENLACES CON ÁTOMOS DE CARBONO O ÁTOMOS DE HIDRÓGENO. POR TANTO, EN LOS ALCANOS EL CARBONO TIENE HIBRIDACIÓN sp3

LA FORMACIÓN DEL METANO EJEMPLIFICA CÓMO TIENE LUGAR LA HIBRIDACIÓN sp3 EN EL ÁTOMO DE CARBONO
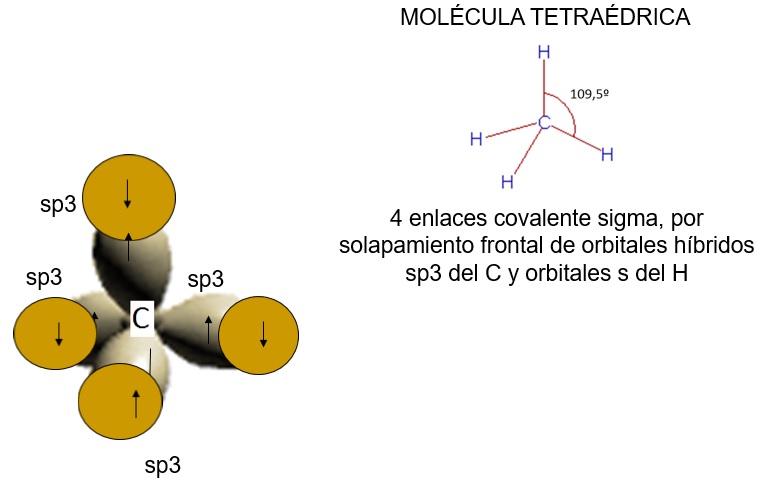
Cada uno de los orbitales híbridos semillenos sp3 del carbono puede solaparse con los orbitales s del átomo de hidrógeno
HIBRIDACIÓN sp2
HIDROCARBUROS ALQUENOS
EN LOS ALQUENOS CADA CARBONO DEL DOBLE ENLACE ESTÁ RODEADO DE TRES GRUPOS ELECTRÓNICO (UN ENLACE DOBLE Y DOS ENLACES SENCILLOS) , POR TANTO EN LOS ÁTOMOS DE CARBONO QUE FORMAN DOBLE ENLACE HAY HIBRIDACIÓN sp2.
LA FORMACIÓN DEL ETENO EJEMPLIFICA CÓMO TIENE LUGAR LA HIBRIDACIÓN sp2 EN EL ÁTOMO DE CARBONO Y LA FORMACIÓN DEL DOBLE ENLACE C=C

El átomo de carbono con hibridación sp2 dispone de tres orbitales híbridos semillenos y de un orbital 2p semilleno perpendicular a ellos. Por tanto, los orbitales híbridos pueden solaparse frontalmente con orbitales s de dos átomos de H y con otro orbital híbrido de otro átomo de C. Además se producirá el solapamiento lateral de los orbitales 2p (no hibridados) dando lugar a un enlace tipo pi.

EL DOBLE ENLACE C=C ES LA SUMA DE DOS TIPOS DIFERENTES DE ENLACE, UNO TIPO PI Y OTRO TIPO SIGMA.
HIBRIDACIÓN sp
HIDROCARBUROS ALQUINOS
EN LOS ALQUINOS CADA CARBONO DEL TRIPLE ENLACE ESTÁ RODEADO DE DOS GRUPOS ELECTRÓNICOS (UN ENLACE TRIPLE Y UN ENLACE SENCILLO) , POR TANTO EN LOS ÁTOMOS DE CARBONO QUE FORMAN EL TRIPLE ENLACE HAY HIBRIDACIÓN sp
LA FORMACIÓN DEL ACETILENO EJEMPLIFICA CÓMO TIENE LUGAR LA HIBRIDACIÓN sp EN EL ÁTOMO DE CARBONO Y LA FORMACIÓN DEL TRIPLE ENLACE C ≡ C

El átomo de carbono con hibridación sp dispone de dos orbitales híbridos semillenos y de dos orbital 2p semillenos perpendiculares a ellos. Por tanto, los orbitales híbridos de un átomo de carbono pueden solaparse frontalmente con un orbital s de un átomo de H y con otro orbital híbrido de otro átomo de C. Además se producirá el solapamiento lateral de los dos pares de orbitales 2p (no hibridados) dando lugar a dos enlaces tipo pi.

EL TRIPLE ENLACE C ≡ C ES LA SUMA DE DOS TIPOS DIFERENTES DE ENLACE, UNO DE TIPO PI Y DOS DE TIPO SIGMA.
HIBRIDACIÓN EN ÁTOMOS DE NITRÓGENO Y OXÍGENO
LA FORMACIÓN DE LA MOLÉCULA DE AMONIACO EJEMPLIFICA CÓMO TIENE LUGAR LA HIBRIDACIÓN sp3 EN EL ÁTOMO DE NITRÓGENO
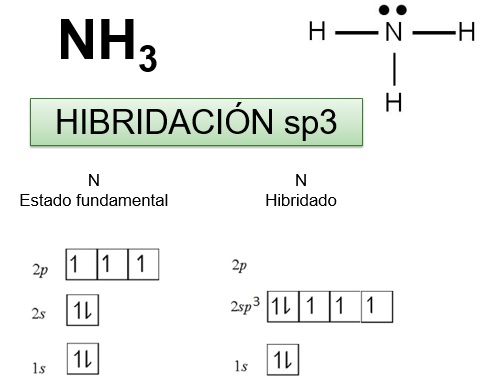
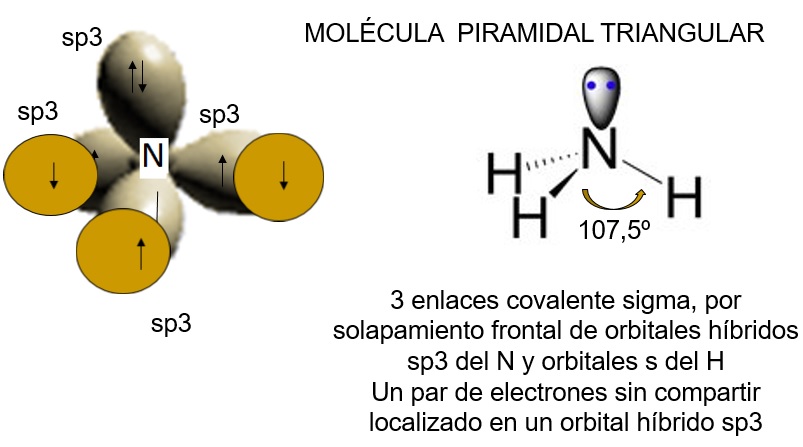
El átomo de nitrógeno con hibridación sp3 dispone de tres orbitales híbridos semillenos que pueden solaparse con los orbitales s semillenos de tres átomos de hidrógeno
LA FORMACIÓN DE LA MOLÉCULA DE AGUA EJEMPLIFICA CÓMO TIENE LUGAR LA HIBRIDACIÓN sp3 EN EL ÁTOMO DE OXÍGENO
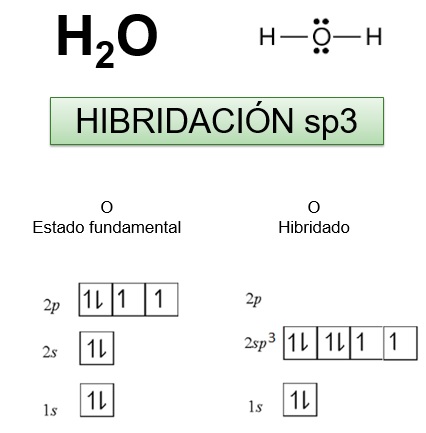
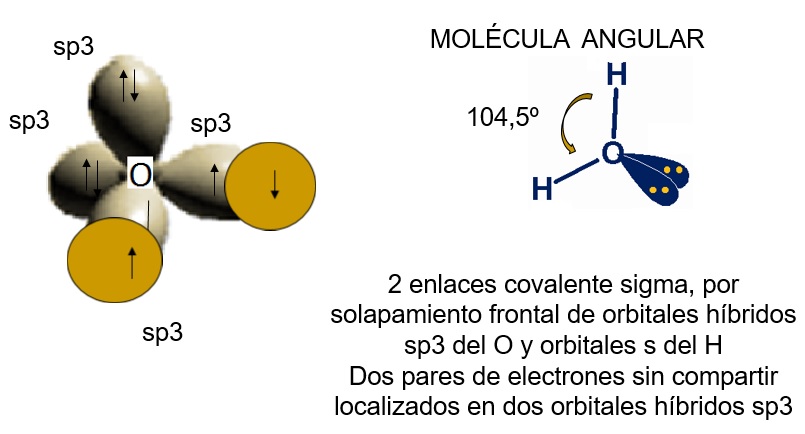
El átomo de oxígeno con hibridación sp3 dispone de dos orbitales híbridos semillenos que pueden solaparse con los orbitales 1s semillenos de dos átomos de hidrógeno
HIBRIZACIÓN CON ORBITALES d
La hibridación de orbitales atómicos no se limita a los de tipo s o p. En los elementos del tercer periodo (y sucesivos) del SP se pueden producir hibridaciones en las que, además de los orbitales ns y np, pueden intervenir los orbitales nd. En los compuestos formados por estos elementos como átomo central se pueden establecer más de cuatro enlaces covalentes, por ejemplo, PF5 o SF6.
En el primero de esos compuestos, el fósforo presenta una hibridación sp3d, dando lugar a cinco orbitales híbridos no equivalentes: tres de ellos se orientan hacia los vértices de un triángulo equilátero y los otros dos lo hacen perpendicularmente al plano del triángulo.
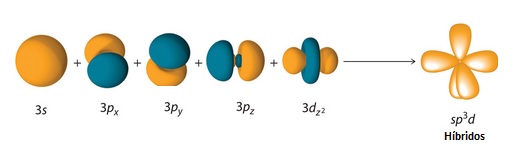
PF5 bipirámide trigonal
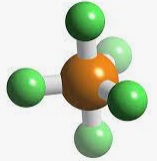
En el segundo de esos compuestos, el azufre presenta una hibridación sp3d2, dando lugar a seis orbitales híbridos equivalentes orientados hacia los vértices de un octaedro.


SF6 octaedro
Aunque en este caso las previsiones de estas geometrías basadas en la hibridación de orbitales atómicos concuerdan con las obtenidas por aplicación del MRPECV, la teoría de la hibridación presenta muchas ventajas.
Una hibridación en la que intervengan orbitales d permite explicar por qué los elementos del segundo periodo puedan formar como máximo cuatro enlaces covalentes en los compuestos en los que sus átomos ocupen el centro de la molécula (CF4) y, sin embargo, los del tercer periodo si puedan establecer cinco o más (SiF62-). Mientras que el dianión hexafluoruro de azufre es estable, el equivalente de carbono no se conoce (CF62-). Como el átomo de C no tiene orbitales d en su capa de valencia, para formar ese dianión octaédrico necesitaría hibridar los orbitales 2s - 2p con los 3d. La diferencia de energía entre los niveles energéticos de esos orbitales es tan grande que la formación de los enlaces C-F no puede explicar su formación.
Además de esta ventaja sobre MRPECV, la hibridación permite explicar la forma de especies químicas en las que el átomo central tiene un octeto expandido. En estos casos, la hibridación se produce entre los orbitales ns, np y (n-1)d.
FORMA DE MOLÉCULAS CON PHET
CHEMDOODLE WEB COMPONENTS
2 TO 3D COORDINATES
En esta página encontrarás una herramienta que te convierte la estructura esqueletal en una estructura 3D
Con ella podrás comprobar ángulos y formas que en el plano son difíciles de visualizar
