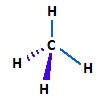
ESTRUCTURA MOLECULAR
MÉTODO DE REPULSIÓN DE PARES DE ELECTRONES DE LA CAPA DE VALENCIA
Las estructuras de Lewis no indican la geometría de las especies químicas pero permiten determinarla si a ellas se les aplica el método de repulsión de pares de electrones de la capa de valencia (MRPECV):
Los pares de electrones se disponen en torno al átomo central de la molécula de modo que se minimicen las repulsiones eléctricas entre ellos, es decir lo más alejados posible
REGLAS PARA APLICAR EL MRPECV
- Dibuje la estructura de Lewis de la especie química
-Cuente el número de regiones de alta densidad electrónica (enlaces o pares de electrones solitarios) en torno al átomo central
-Identifique la forma más estable de colocar esas regiones de alta densidad electrónica (GEOMETRÍA ELECTRÓNICA)
-Coloque los átomos exteriores en torno al átomo central respetando la disposición anterior (GEOMETRÍA MOLECULAR)
LINEAL
LINEAL BeH2
TRIGONAL PLANA
TRIGONAL PLANA BF3
ANGULAR SO2
TETRAÉDRICA
TETRAÉDRICA CH4
PIRAMIDAL TRIGONAL NH3
ANGULAR H2O
BIPIRAMIDAL TRIGONAL
BIP.TRIGONAL PF5
BALANCÍN (TETR.DEFORM) TeCl4
FORMA T BrF3
LINEAL XeF2
OCTAÉDRICA
OCTAÉDRICA SF6
PIRAMIDE CUADRADA IF5
CUADRADA PLANA XeF4
EJEMPLO: AMONIACO
Estructura de Lewis
4 GRUPOS ELECTRÓNICOS EN TORNO AL ÁTOMO CENTRAL DE LA MOLÉCULA (TRES ENLACES Y UN PAR NO COMPARTIDO)
Distribución electrónica: tetraédrica
LOS 4 GRUPOS ELECTRÓNICOS SE COLOCAN LO MÁS SEPARADOS POSIBLE, ES DECIR, SE ORIENTAN HACIA LOS VÉRTICES DE UN TETRAEDRO
Geometría molecular: piramidal
SOLO TRES GRUPOS ELECTRÓNICOS SE UNEN A ÁTOMOS DE HIDRÓGENO. LA MOLÉCULA TIENE FORMA PIRAMIDAL TRIANGULAR
FORMA DE MOLÉCULAS CON PHET
Ejemplo: METANO (CH4)
1.- Estructura de Lewis
2.- Geometría electrónica
Como hay cuatro grupos electrónicos (enlaces) rodeando al átomo central (C) la geometría electrónica es tetraédrica
3.- Geometría molecular
Como hay cuatro átomos de H que se unen a los cuatro vértices del tetraedro, la geometría molecular también será tetraédrica. Ángulo de enlace 109,5 º.
Ejemplo: ETENO (CH2CH2)
1.- Estructura de Lewis
2.- Geometría electrónica
Cada átomo de carbono está rodeado de tres grupos electrónicos (un enlace doble y dos enlaces sencillos). En consecuencia la geometría electrónica en torno a ambos átomos es triangular (plana).
3.- Geometría molecular
Como hay cuatro átomos de H que se unen a los cuatro vértices, la geometría molecular también será plana. Ángulo de enlace 120 º.

Ejemplo: PROPINO (CH3C≡CH)
1.- Estructura de Lewis
2.- Geometría electrónica
Cada uno de los dos átomos de carbono involucrados en el triple enlace está rodeados de dos grupos electrónicos (un enlace triple y un enlace sencillo). En consecuencia la geometría electrónica en torno a ambos átomos es linear.
3.- Geometría molecular
Como hay dos grupos (uno metilo y un átomo de H) unidos a los extremos, la geometría molecular también será lineal. Ángulo de enlace 180 º.
![]()
Ejemplo: DIMETILÉTER (CH3OCH3)
1.- Estructura de Lewis
2.- Geometría electrónica
El átomo de oxígeno está rodeado de cuatro grupos electrónicos (dos enlaces sencillos y dos pares de electrones no compartidos). En consecuencia la geometría electrónica en torno a ese átomo es tetraédrica
3.- Geometría molecular
Como solo hay dos grupos metilo para unir a dos de los vértices del tetraedro, la geometría molecular será, por tanto, angular. Ángulo de enlace 109,5 º.

Ejemplo: ETANOL (CH3CH2OH)
1.- Estructura de Lewis
2.- Geometría electrónica
El átomo de oxígeno está rodeado de cuatro grupos electrónicos (dos enlaces sencillos y dos pares de electrones no compartidos). En consecuencia la geometría electrónica en torno a ese átomo es tetraédrica
3.- Geometría molecular
Como solo hay un grupo etilo y un átomo de H para unir a dos de los vértices del tetraedro, la geometría molecular será, por tanto, angular. Ángulo de enlace 109,5 º.

Ejemplo: METILAMINA (CH3NH2)
1.- Estructura de Lewis
2.- Geometría electrónica
El átomo de nitrógeno está rodeado de cuatro grupos electrónicos (tres enlaces sencillos y un par de electrones no compartidos). En consecuencia la geometría electrónica en torno a ese átomo es tetraédrica
3.- Geometría molecular
Como solo hay un grupo metilo y dos átomos de H para unir a tres de los vértices del tetraedro, la geometría molecular será, por tanto, piramidal triangular. Ángulo de enlace 107,8 º.

Ejemplo: ACETONA (PROPANONA) (CH3COCH3)
1.- Estructura de Lewis
2.- Geometría electrónica
El átomo de carbono central está rodeado de tres grupos electrónicos (dos enlaces sencillos y un enlace doble). En consecuencia la geometría electrónica en torno a ese átomo es triangular (plana)
3.- Geometría molecular
Como los tres vértices del triángulo están unidos, respectivamente, a dos grupos metilo y un átomo de O, la geometría molecular será, por tanto, triangular plana. Ángulo de enlace 120 º.

Ejemplo: ÁCIDO ACÉTICO (ETANOICO) (CH3COOH)
1.- Estructura de Lewis
2.- Geometría electrónica
La geometría electrónica en torno al átomo de C de la izquierda es tetraédrica (lo rodean cuatro grupos electrónicos: cuatro enlaces simples). Sin embargo, en torno al átomo de C de la derecha es triangular plana (lo rodean tres grupos electrónicos: dos enlaces simples y uno doble).


tetraédrica -------triangular
3.- Geometría molecular
Como ambos carbonos tienen sus vértices ocupados, las geometrías moleculares de ambos carbonos coinciden con las electrónicas: tetraédrica y triangular plana, respectivamente. En el primer carbono el ángulo de enlace será 109,5º y en el segundo 120º.


Ejemplo: ACETAMIDA (ETANAMIDA) (CH3CONH2)
1.- Estructura de Lewis
2.- Geometría electrónica
La geometría electrónica en torno al átomo de C de la izquierda es tetraédrica (lo rodean cuatro grupos electrónicos: cuatro enlaces simples). En torno al átomo de C de la derecha es triangular plana (lo rodean tres grupos electrónicos: dos enlaces simples y uno doble). En torno al átomo de nitrógeno es tetraédrica (lo rodean cuatro grupos electrónicos: tres enlaces y un par de electrones no compartido).



tetraédrica -------triangular---------tetraédrica
3.- Geometría molecular
Como ambos carbonos tienen sus vértices ocupados, las geometrías moleculares de ambos carbonos coinciden con las electrónicas: tetraédrica y triangular plana, respectivamente. En el primer carbono el ángulo de enlace será 109,5º y en el segundo 120º.
Sin embargo, en el átomo de nitrógeno solo hay ocupados tres de los cuatro vértices del tetraedro, dando como resultado una geometría molecular piramidal triangular. Ángulo de enlace 107,8º.

tetraédrico

triangular (plano)

piramidal
Ejemplo: ACETONITRILO (CH3CN)
1.- Estructura de Lewis
2.- Geometría electrónica
La geometría electrónica en torno al átomo de C de la izquierda es tetraédrica (lo rodean cuatro grupos electrónicos: cuatro enlaces simples). En torno al átomo de C de la derecha es lineal (lo rodean dos grupos electrónicos: un enlace simple y uno triple).

![]()
tetraédrica -------lineal
3.- Geometría molecular
Como ambos carbonos tienen sus vértices ocupados, las geometrías moleculares de ambos carbonos coinciden con las electrónicas: tetraédrica y lineal, respectivamente. En el primer carbono el ángulo de enlace será 109,5º y en el segundo 180º.

tetraédrico
![]()
lineal
CHEMDOODLE WEB COMPONENTS
2 TO 3D COORDINATES
En esta página encontrarás una herramienta que te convierte la estructura esqueletal en una estructura 3D
Con ella podrás comprobar ángulos y formas que en el plano son difíciles de visualizar
CHEMDOODLE WEB COMPONENTS
MOLGRABBER 3D
En esta página encontrarás una herramienta que te permite visualizar en 3D las moléculas que son los principios activos de medicinas muy comunes