CARGAS FORMALES
¿QUÉ ES LA CARGA FORMAL?
Denominamos carga formal a la carga teórica que tendría un átomo en una especie química después de aplicar la siguiente regla teórica:

CV es el número de electrones que contiene en su capa de valencia en el estado fundamental. Por ejemplo:
Carbono : 4 electrones
Nitrógeno: 5 electrones
Oxígeno: 6 electrones
Halógenos: 7 electrones
ENC es el número de electrones que el átomo no comparte. Pueden ser uno más pares de electrones, o un solo electrón como en el caso de los radicales.
NE es el número de enlaces que el átomo forma con átomos vecinos. Se corresponde con la mitad del número de los electrones de enlace.
LA SUMA DE TODAS LAS CARGAS FORMALES QUE APARECEN EN UNA ESPECIE QUÍMICA DEBE SER IGUAL A SU CARGA ELÉCTRICA, CERO SI ES NEUTRA, DIFERENTE DE CERO SI ES UN ION.
CÁLCULO DE CARGAS FORMALES
¿Cuál es la carga formal del oxígeno en el ion hidronio?

En este caso, como la imagen indica el número de electrones no compartidos, el cálculo es muy sencillo
CV = 6 (se trata de un átomo de oxígeno)
ENC = 2 (hay un par de electrones no compartido)
NE = 3 (el oxígeno foma tres enlaces simples con átomos de hidrógeno)
CF = 6 - 2 - 3 = 1
La carga formal del átomo de oxígeno en el ion hidronio es +1

Puede comprobar que la carga formal de los átomos de H es 0. Globalmente el ion hidronio muestra una carga +1
Si aplicamos la misma estrategia a las siguientes especies:

Encontramos las siguientes cargas formales:

A.1. Determinar las cargas formales de los átomos centrales de las siguientes especies:
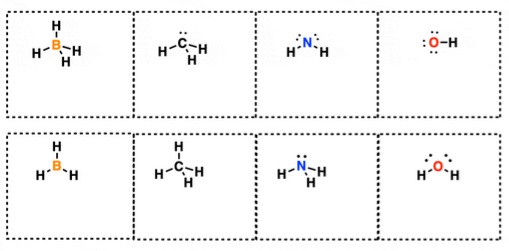

¿Y si usamos fórmulas de líneas?
En estos casos hay que tener en cuenta que los átomos de H son omitidos
A.2. Determinar las cargas formales de los átomos señalados en la siguiente figura (todos los pares de electrones no compartidos han sido indicados):


¿Y si no se indican los electrones no compartidos?
En este caso no hay problemas siempre que conozcamos el grado de cumplimiento del octeto.
A.3. Determinar las cargas formales de los átomos de oxígeno y nitrógeno en los siguientes casos (asumir que el octeto se cumple en todos los casos):


A.4. Determinar las cargas formales en las siguientes estructuras (asumir que el octeto se cumple en todos los casos):


CARGAS FORMALES Y ESTRUCTURA MOLECULAR
En muchos casos el cálculo de las cargas formales nos permite determinar la estructura más probable de una especie química. Este procedimiento se basa en la siguientes reglas:
-
La estructura molecular más estable es aquella con todas las cargas formales cero.
-
Si la estructura debe tener cargas formales diferentes a cero, es preferible la disposición con el menor número de cargas formales.
-
Las estructuras más estables no tienen cargas formales adyacentes del mismo signo.
-
Las estructuras más estables tienen las cargas formales negativas en los átomos más electronegativos.

Por ejemplo, en el caso del dióxido de carbono, la estructura más probable será la primera, es decir, aquella que une el C a los dos átomos de O mediante dobles enlaces. Con esa disposición atómica, las cargas formales son nulas.
A.5. ¿Cuál es la estructura más probable del ion tiocianato?
NCS- ; CNS- ; CSN-

La estructura más probable es la primera porque en ella se minimizan las cargas formales. De hecho solo habría un átomo de N con carga -1.
Otras ventajas de esta estructura es que coloca el átomo más electropositivo en el centro y la carga negativa reside en el átomo más electronegativo
A.6. ¿Cuál es la estructura más probable del óxido nitroso N2O?


La estructura más probable es la primera porque en ella se minimizan las cargas formales.
Las estructuras con más de dos cargas formales distintas de cero no son realistas.
A.7. ¿Cuál es la estructura más probable del ion nitrito?

