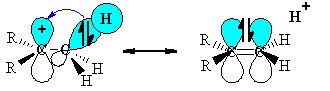ESTRUCTURA MOLECULAR
EFECTOS ELECTRÓNICOS EN LAS MOLÉCULAS
PUDIERA PARECER UN CONTRASENTIDO PENSAR QUE EN UNA MOLÉCULA SE PRODUZCAN DESPLAZAMIENTOS DE ELECTRONES. EN LOS ENLACES COVALENTES LOS ELECTRONES ESTÁN LOCALIZADOS ENTRE LOS ÁTOMOS, NO PUEDEN DESPLAZARSE YA QUE MANTIENEN UNIDA LA ESTRUCTURA
SIN EMBARGO, EN LAS MOLÉCULAS ORGÁNICAS SE PRODUCEN EFECTOS ELECTRÓNICOS, LOS PRINCIPALES SON EL EFECTO INDUCTIVO Y EL EFECTO RESONANTE. NO PODEMOS ENTENDER EL COMPORTAMIENTO DE LAS SUSTANCIAS ORGÁNICAS SIN TENERLOS EN CUENTA
EFECTO INDUCTIVO
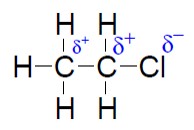
El átomo de cloro es más electronegativo que el átomo de carbono, por tanto, deplaza hacia él los electrones de enlace. Esto provoca que el átomo de cloro disponga de una carga parcial negativa y que al átomo de carbono adyacente le ocurra lo mismo pero con una carga parcial positiva. Este desplazamiento de carga permanente se prolonga algunos carbonos a lo largo de los enlaces σ de la cadena carbonada.
EFECTO RESONANTE
En el ion acetato hay pares de electrones no compartidos que se desplazan aprovechando su posibilidad de formar o romper dobles enlaces. El resultado es que la carga eléctrica negativa del ion no se encuentra estacionaria sobre uno de los átomos de oxígeno sino que se desplaza entre ellos. Hay deslocalización de electrones. Lo mismo podríamos decir del doble enlace que une el carbono con el oxígeno. No se encuentra fijo. Se forma y de destruye continuamente, provocando que el enlace entre ambos átomos no sea realmente ni simple ni doble.
EFECTO ELECTROMÉRICO
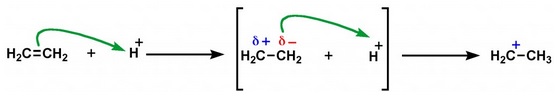
Es el movimiento electrónico que se produce en una molécula cuando se le aproxima otra. Por ejemplo, si un ion hidrógeno se aproxima al un doble enlace C=C, este se polariza en dirección al ion. Si el ion que produce la polarización del enlace es positivo, el efecto electromérico se denomina +E. Cuando se aproxima un ion cargado negativamente (por ejemplo, un ion hidroxilo) nos referimos a él como efecto electromérico -E.
HIPERCONJUGACIÓN
La hiperconjugación es la interacción estabilizante que se produce entre los electrones de un enlace σ (habitualmente C-H o C-C) con un orbital p o un orbital π adyacente vacío o semilleno para dar un orbital molecular extendido que aumenta la estabilidad del sistema.
Por ejemplo, un carbocatión se puede estabilizar por hiperconjugación. Como el orbital p vacío que porta la carga positiva está en el mismo plano que uno de los enlaces σ del grupo CH3 adyacente, se puede producir una interacción entre ambos.