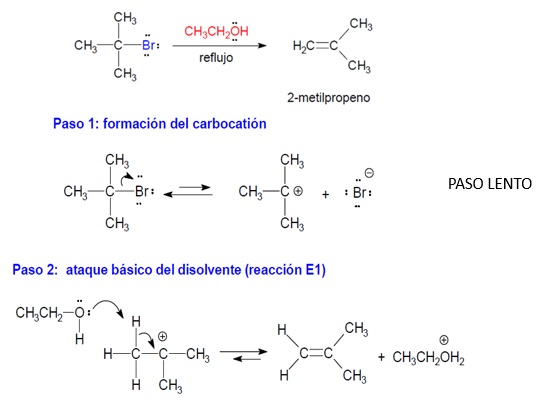
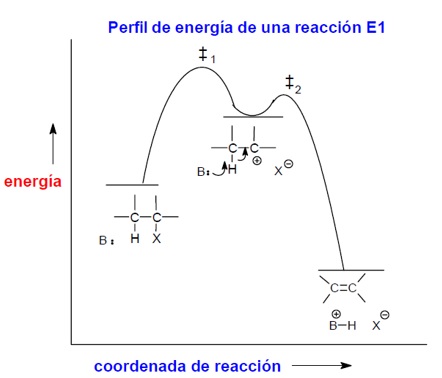
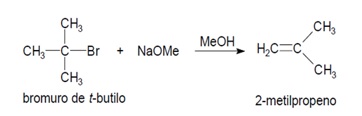
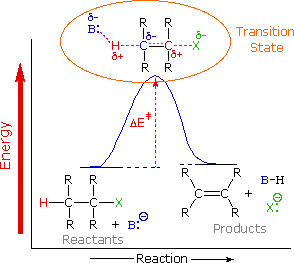
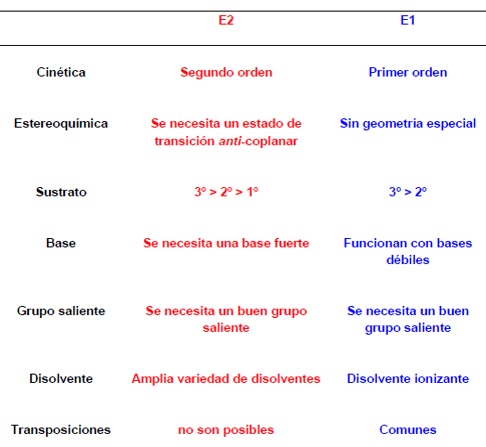
2.- BASE
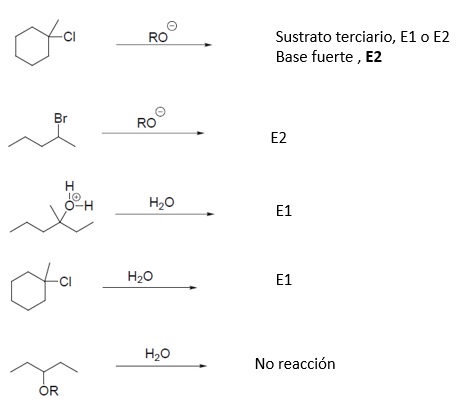
EJEMPLO
Valorar qué mecanismos favorecen las siguientes bases:

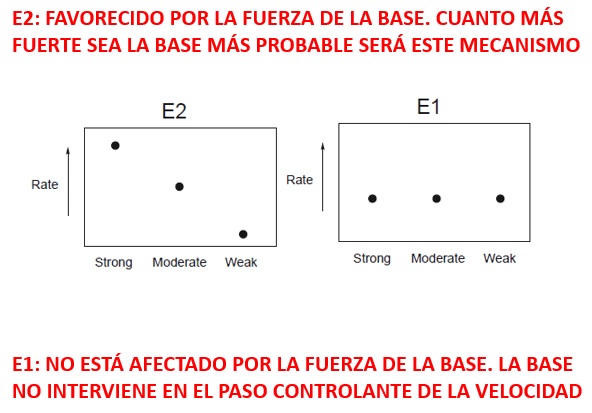
Nota: tanto la basicidad como la nucleofilia aumentan al pasar de un especie neutra a otra cargada negativamente
Recordatorio:

3.- GRUPO SALIENTE
El grupo saliente tiene el mismo efecto en las reacciones de sustición como en las de eliminación. Para que ambas se produzcan, es necesario que el grupo saliente se aleje del sustrato. Por ello cuanto mejor sea el grupo saliente mayor velocidad se observará en cualquiera de los mecanismos E1 y E2. Sin embargo, como el paso controlante de la velocidad en E1 es precisamente la formación del carbocatión como efecto de la separación del grupo saliente, es esperable que la eliminación E1 sea especialmente sensible a su facilidad de alejamiento.

EJEMPLO
Calificar los siguientes grupos salientes como malos, buenos y excelentes. En base a ello, valorar qué mecanismo E1, E2 o ambos, se producirá.

Nota: Tres de ellos se podrían calificar como buenos y favorecerían ambos mecanismos. Dos son malos y no favorecen ningun. Hay un grupo saliente excelente que favorecería la E1.
4.- DISOLVENTE
El medio en el que se produzca la reacción es importante de cara al mecanismo. Si el disolvente utilizado es prótico, estabilizará el carbocatión favoreciendo el mecanismo E1 y bloqueará la fuerza de la base atacante perjudicando el mecanismo E2. Todo lo contrario ocurriría con un disolvente aprótico. En este caso se vería favorecido el mecanismo E2, sobre todo si la base se encuentra en alta concentración.