
ENOLES Y ENOLATOS

Los enoles son compuestos que tienen un grupo hidroxilo unido a un carbono que participa de un doble enlace. El hecho de que el alqueno esté unido a un sustituyente que dona carga hace que su carácter nucleófilo se vea incrementado, siendo más reactivo que un simple alqueno.
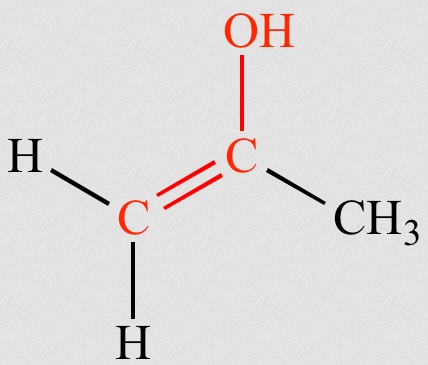
Los enolatos son las bases conjugadas de los enoles
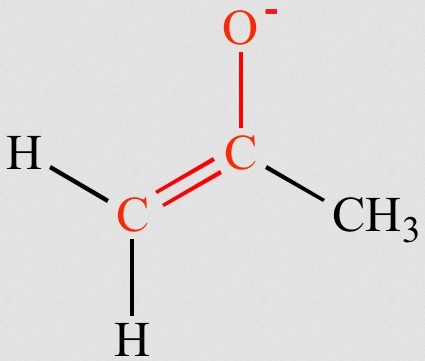
El ion enolato se estabiliza por resonancia. Como resultado, la carga negativa se comparte entre el O y el C en posición alfa.

TAUTOMERÍA CETOENÓLICA
Los enoles son tautómeros de los compuestos carbonílicos. Por ejemplo, la acetona es el tautómero (isómeros estructurales que se diferencian en la posición de un H) del 2 propenol. En general, como los enoles son menos estables, ese equilibrio está desplazado hacia el compuesto carbonílico.

La interconversión entre las formas enol y ceto se puede producir en medio ácido o básico.
En medio ácido el enol es protonado en el doble enlace. El carbocatión resultante es estabilizado por resonancia con el grupo hidroxilo. La desprotonación final da lugar a la forma ceto.

Mirando el proceso en sentido contrario observamos que un compuesto carbonílico en medio ácido tiene tendencia a formar un enol.
En medio básico, la base abstrae el protón del grupo hidroxilo del enol. El ion enolato obtenido se estabiliza por resonancia. Por último, la protonación del C en alfa da lugar a la forma ceto.
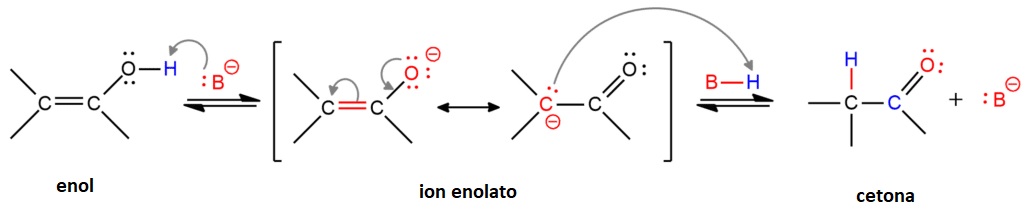
De igual manera podríamos interpretar el proceso en sentido inverso. Una base fuerte puede abstraer un H en alfa de la forma ceto produciendo el ion enolato que, a continuación, es protonado para producir la foma enol. Comprobamos, por tanto, que en presencia de una base fuerte, tanto la forma ceto como la forma enol pueden perder un protón convirtiéndose en el mismo ion enolato.
Importante: el compuesto carbonílico puede formar un enol en medio ácido y un ion enolato en medio básico
ESTABILIDAD DE LA FORMA ENOL
A pesar de que la forma ceto es más estable que la forma enol, en ciertas condiciones el equilibrio se puede desplazar hacia la forma enol. Los dos principales factores que favorecen la forma enol son los siguientes:
1.- Aromaticidad
Si con la forma enólica se alcanza la aromaticidad de la molécula, el equilibrio estará completamente desplazado hacia ella. Es lo que ocurre con el fenol. Su forma ceto no se conoce.

2.- Puentes de hidrógeno
Los puentes de hidrógeno pueden estabilizar la forma enol. Cuando una base Lewis está presente la forma enólica se estabiliza por la formación de puentes de hidrógeno internos. Esto ocurre, por ejemplo, en las 1,3 dicetonas.

Otros tres factores pueden influir en la tautomería cetoenólica
3.- Disolvente
Los disolventes apolares como el benceno favorecen la forma enol porque los puentes de hidrógeno intramoleculares que la estabilizan no se rompen para establecerse con las moléculas del disolvente. Esto último si puede ocurrir con un disolvente polar prótico como el agua. La 2,4-pentanodiona está en su forma enólica en un 94 % en benceno y, por el contrario, está en su forma ceto en un 81 % en agua.

4.- Conjugación
La forma enólica puede ser la preferida si la posición del doble enlace del enol facilita la conjugación con otro sistema pi.

5.- Sustitución
La estabilidad de los alquenos aumenta con el nivel de sustitución. Este efecto también es aplicable a los enoles.

En cuanto a la reactividad de los iones enolato habrá que tener en cuenta que pueden actuar como nucleófilos tanto en el oxígeno como en el carbono.
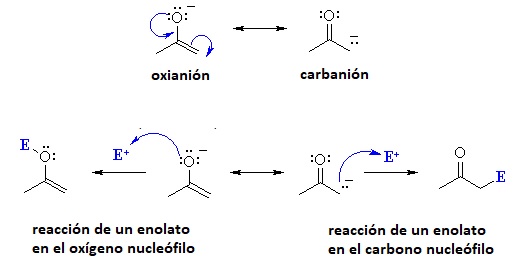
Las reacciones más comunes del ion enolato tienen lugar en el C alfa, sin embargo, hay ocasiones en las que se producen en el oxígeno y este hecho permite "capturar" el enolato.
La pérdida del H en alfa será más fácil (mayor acidez) cuanto más estable sea el carbanión que se obtiene (ion enolato). En esta tarea de estabilización juegan un papel fundamental los grupos atractores de carga como nitrilo, carboxilo, sulfónico, ..

Los compuestos con dos grupos electrón atrayentes presentan H alfa más ácidos debido a la mayor estabilización del carbanión.

