INTERMEDIOS DE REACCIÓN
DIFERENCIAS ENTRE INTERMEDIO DE REACCIÓN Y ESTADO DE TRANSICIÓN
Un intermedio de reacción es una especie química que se forma a lo largo del proceso de conversión de los reactivos en productos. Es el producto de una reacción elemental y el reactivo de otra. Suele ser inestable y tener un tiempo de vida corto (pero puede no ser así siempre, de hecho el tiempo de vida de un intermedio puede durar desde nanosegundos a días)
Un estado de transición es justo el estado previo a la formación de una nueva molécula. En él se están produciendo la formación y ruptura de enlaces, por lo que es especialmente energético e inestable.
Mientras un estado de transición es imposible de detectar, un intermedio de reacción existe durante un tiempo y, potencialmente, podría ser aislado.
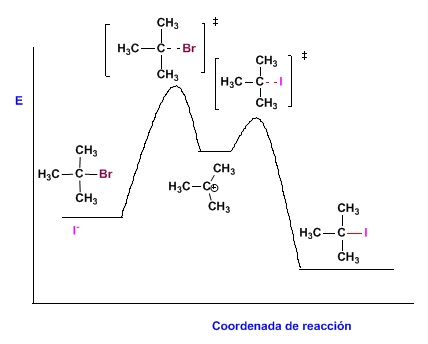
El diagrama de energía potencial de una reacción química ejemplifica las diferencias entre intermedio de reacción y estado de transición
Los dos estados de transición ocupan máximos locales de energía. En el primero se está rompiendo el enlace C-Br. En el segundo se está formando el enlace C-I.
El intermedio de reacción ocupa un mínimo local de energía, en este caso es un carbocatión que existe entre los dos estados de transición.
Los intermedio de reacción más comunes en las reacciones orgánicas son:
CARBOCATIONES
CARBANIONES
RADICALES LIBRES
CARBENOS
CARBOCATIONES
Un carbocatión es una especie química que tiene un carbono con una carga positiva enlazado a tres átomos vecinos. Ese carbono es deficiente electrónicamente, sólo está rodeado de seis electrones (no cumple la regla del octeto). La hibridación del átomo de carbono central es sp2, es decir, tiene geometría plana

ESTABILIDAD DE LOS CARBOCATIONES
Experimentalmente sabemos que el orden de estabilidad de los carbocationes es el siguiente:

Los carbocationes más estables son aquellos que presentan resonancia, en particular los de tipo bencilo y alilo. Observe que el carbono con carga positiva es vecino de un doble enlace con el que puede entrar en resonancia. De esa manera la carga positiva se reparte en diversos lugares de la molécula.

En la estabilidad de los carbocationes terciarios, secundarios y primarios no interviene el efecto resonante, en su lugar, el orden de estabilidad se explica por dos efectos electrónicos:
- El efecto inductivo (+I) de los grupos alquilo. Cuantos más grupos alquilo cedan carga al átomo de carbono deficiente del carbocatión, más estable será este.

- La hiperconjugación. La cesión de carga entre enlaces sigmas paralelos y el orbital p vacío del carbocatión. En el caso del carbocatión terciario el solapamiento del orbital p vacío se puede realizar con tres enlaces sigma C-H de cada uno de los grupos metilo que lo rodean. En los secundarios con dos, en los primarios con uno y en el metilo con ninguno.

TRANSPOSICIÓN DE CARBOCATIONES
Una característica importante de los carbocationes es su tendencia a sufrir transposición, es decir, a la migración de un átomo de hidrógeno o de un grupo alquilo con su par de electrones desde un carbono vecino hacia el que tiene la carga positiva

La energía necesaria para que se produzca la transposición es menor que la ganancia de estabilidad que sufre la especie química. Por ello, si se dan las circunstancias para ello, el carbocatión se transformará de primario en secundario o de secundario en terciario. Esta tendencia a transponerse es una dificultad en algunas reacciones de síntesis, sin embargo, es una gran ventaja, por ejemplo, en la producción de gasolina de alto octanaje, en la que se requieren hidrocarburos muy ramificados.
Transposición de carbocationes (flash)
TRANSFORMACIONES DE LOS CARBOCATIONES
Los cuatro procesos típicos que sufren los carbocationes son los siguientes:
Transferencia de metilo (Transposición)
Transferencia de hidruro (Transposición)
Pérdida ion H+ a causa de un ataque básico
Paso controlante de las reacciones de eliminación E1
Combinación con nucleófilo
Paso controlante de las reacciones de sustitución SN1
A continuación dispone de varias simulaciones sobre carbocationes
Reacciones con Carbocationes
Quiralidad y Carbocationes
Hidrólisis de Olefinas- Formación de Alcoholes
Estabilización de iones
CARBANIONES
Un carbanión es una especie química que tiene un carbono con una carga negativa. Está enlazado a tres átomos vecinos y, además, porta un par de electrones no compartido. Ese carbono está rodeado de ocho electrones (si cumple la regla del octeto). La hibridación del átomo de carbono central es sp3, es decir, tiene geometría electrónica tetraédrica

ESTABILIDAD DE LOS CARBANIONES
Experimentalmente sabemos que el orden de estabilidad de los carbaniones es el siguiente:

Los carbaniones más estables son aquellos que presentan resonancia, en particular los de tipo bencilo y alilo. El carbono con carga negativa es vecino de un doble enlace con el que puede entrar en resonancia. De esa manera la carga negativa se reparte en diversos lugares de la molécula.
En cuanto a los carbaniones de tipo aquilo, el menos estable es el terciario. En este caso el efecto inductivo (+I) de cesión de carga inestabiliza la carga negativa central. Por el contrario, el carbanión metilo es el más estable al estar libre de ese efecto inductivo.
Un aspecto a tener en cuenta en la estabilidad de los carbaniones es la hibridación del carbono que porta la carga negativa. La estabilidad aumenta a medida que aumenta el carácter s del orbital híbrido ya que los electrones se encuentran más cercanos al núcleo.

RADICALES LIBRES
Un radical libre es una especie química sin carga eléctrica que tiene un átomo de carbono con un electrón no compartido. Ese carbono es deficiente electrónicamente porque solo está rodeado de siete electrones (no cumple la regla del octeto). La hibridación del átomo de carbono central es sp2, es decir, tiene geometría electrónica plana, pero a diferencia de los carbocationes el orbital p no hibridado contiene un electrón solitario.
ESTABILIDAD DE LOS RADICALES LIBRES
Experimentalmente sabemos que el orden de estabilidad de los radicales libres es el siguiente:
Los radicales más estables son aquellos que presentan resonancia, en particular los de tipo bencilo y alilo. El carbono con deficiencia de carga es vecino de un doble enlace con el que puede entrar en resonancia. De esa manera el electrón no compartido se reparte en diversos lugares de la molécula.
En cuanto a los radicales de tipo aquilo,se cumple la misma regla que en los carbocationes. El más estable es el terciario y el menos el metilo.
En radical terciario es aproximadamente 3 kcal/mol más estable que uno secundario, 6 kcal/mol que uno primario y 13 kcal/mol que uno metilo.
Para explicar este orden de estabilidad se puede recurrir a los mismo efectos electrónicos que en los carbocationes: efecto inductivo y hiperconjugación.
Hiperconjugación en un radical terciario
Sin embargo, las diferencias de energía entre los radicales primario y terciario es tan pequeña (del orden de 6 kcal/mol) que no es habitual que se produzca la transposición que se daba en los carbocationes.
¿Por qué los carbocationes se transmutan y los radicales no?

Las diferencias de energías (estabilidad) entre los carbocationes son mucho más grandes que entre los radicales. Por tanto, cuando un carbocatión primario se transmuta en uno terciario, por ejemplo, la ganancia de estabilidad es muy grande y el descenso en la energía potencial del sistema es suficiente como para inducir las rupturas de enlaces necesarias para que el proceso ocurra. En los radicales esta situación no se da.
CARBENOS