
EFECTOS DE LAS
FUERZAS INTERMOLECULARES

Las fuerzas intermoleculares controlan algunas de las propiedades de las sustancias moleculares, por ejemplo, el punto de ebullición y la solubilidad
EFECTO SOBRE EL PUNTO DE EBULLICIÓN
Durante la ebullición de los líquidos, las moléculas se separan venciendo las fuerzas intermoleculares que las unen, por consiguiente, la temperatura de ebullición está intimamente relacionada con la intensidad de las fuerzas que unen las moléculas. Cuanto más intensas sean las fuerzas intermoleculares más difícil será separar sus moléculas y, por tanto, más alto será su punto de ebullición.
¿Por qué el metano (CH4) es un gas y el metanol (CH3OH) es un líquido a temperatura ambiente?


La razón hay que buscarla en el tipo de fuerzas que unen las moléculas de ambas sustancias:
- Metano: (apolar) Sus moléculas solo están unidas por débiles Fuerzas de Dispersión de London. Es esperable que hierva a temperaturas muy bajas (-161 ºC) y sea gas a temperatura ambiente.
- Metanol: Sus moléculas son polares y tienen enlaces O-H. Presentará Fuerzas de Dispersión de London, Fuerzas dipolo-dipolo y, además, Puentes de Hidrógeno. Es esperable que hierva a una temperatura mucho mayor que el metano (65 ºC).
¿Qué sustancia hierve a mayor temperatura el etanol o el dimetiléter? Son sustancias isoméricas (46 g/mol)

¿Qué tipo de fuerza intermolecular existe en cada caso?
- Etanol: Sus moléculas son polares y presenta enlace O-H. Las fuerzas intermoleculares serán intensas, incluyendo: Fuerzas de Dispersión de London, Fuerzas dipolo-dipolo y Puentes de Hidrógeno. Hierve a 78 ºC.
- Dimetiléter: Sus moléculas son polares pero no presenta enlace O-H. No presentará Puentes de Hidrógeno. En consecuencia hervirá a menor temperatura que el etanol. Hierve a -24 ºC.
El hexano tiene un punto de ebullición de 69 ºC, la 3-hexanona de 123 ºC y el 3-hexanol de 135 ºC. ¿Cuál es la causa de unas diferencias tan notables en el punto de ebullición de estas sustancias?

Colocar en orden creciente de puntos de ebullición las siguientes sustancias:

EFECTO SOBRE LA SOLUBILIDAD
Cuando una sustancia disuelve a otra, las moléculas de ambas interaccionan, por tanto, cuanto más parecidas sean las fuerzas intermoleculares entre ellas más fácil será el proceso de disolución.
PRINCIPIO: SEMEJANTE DISUELVE A SEMEJANTE

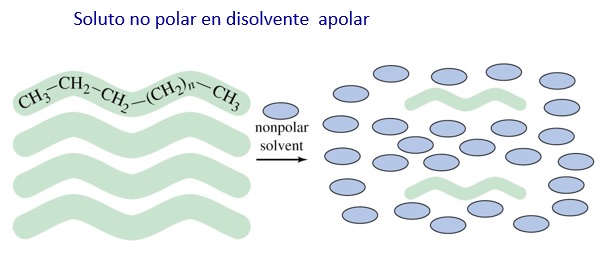
Una sustancia apolar será disuelta por un disolvente apolar. Una sustancia polar será disuelta por un disolvente polar.

Por ejemplo, un disolvente apolar como el hexano disolverá sustancias apolares como las grasas. Sin embargo, un disolvente polar como el agua disolverá sustancias polares como el cloruro de sodio.
¿Qué sustancia es más soluble en agua el etano o el etanol?
Etano: Sustancia apolar. Sólo presenta Fuerzas de dispersión de London entre sus moléculas. No será soluble en agua
Etanol: Sustancia polar con enlaces O-H. Presenta Fuerzas de Dispersión de London, Fuerzas Dipolo-Dipolo y Puentes de Hidrógeno. Las mismas fuerzas que están presentes en el agua, por tanto, será extremadamente soluble en este disolvente.
¿Qué hacemos cuando tenemos la mala suerte de que una gota de aceite nos caiga sobre la camisa?
El primer impulso es frotar con agua. El resultado es negativo. La mancha continúa allí. La razón es sencilla: el agua (polar) no puede disolver sustancias apolares como el aceite. Sin embargo, si usamos un producto quitagrasas basado en hidrocarburos (por ejemplo hexano) la mancha desaparece con facilidad. La razón es sencilla: el hexano (apolar) ha disuelto el aceite que también es apolar.
Lavar la ropa con jabón. Una manera de solubilizar las grasas en agua.
Las moléculas de jabón son largas y tienen un extremo hidrófilo (soluble en agua) y otro lipófilo (soluble en grasas). Cuando las moléculas de jabón se encuentran una gota de grasa hunden en ella su extremo lipófilo, quedando el hidrófilo hacia afuera, es decir en contacto con el agua. Se forma una micela. Una gota de grasa solubilizada en agua.






