REACCIONES REDOX
AGENTES REDUCTORES Y OXIDANTES
Un reductor es una especie química que reduce a otra mientras ella se oxida. Entre los reductores habituales en Química Orgánica encontramos los siguientes:

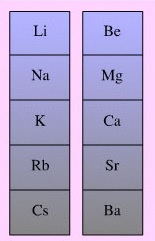
Los metales activos, electropositivos, son por naturaleza agentes reductores ya que tienen elevados potenciales normales de reducción. Por ejemplo, el sodio se utiliza disuelto en amoniaco.
El hidrógeno H2 se utiliza junto con catalizadores basados en metales (Pd, Pt, ..)
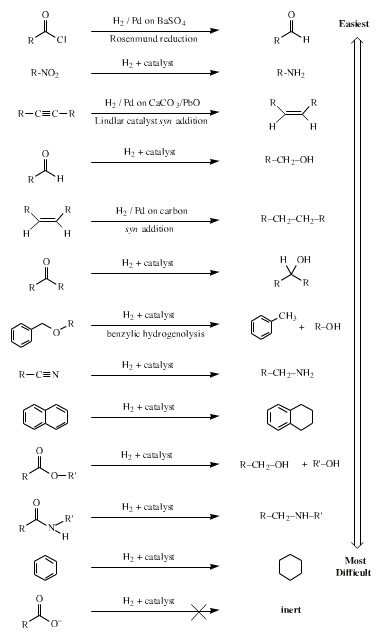
Los hidruros son ampliamente utilizados en procesos de reducción, en particular los hidruros complejos como el DIBAL (hidruro de diisobutilaluminio).
Entre ellos están el borohidruro de sodio y el hidruro doble de litio y aluminio. El primero reduce aldehidos y cetonas a alcoholes, el segundo, más activo, es capaz de reducir ácidos carboxílicos y derivados.

Otros reductor ampliamente utilizado es la hidracina.
NH2NH2
Un oxidante es una especie química que oxida a otra mientras ella se reduce. Entre los oxidantes habituales en Química Orgánica encontramos los siguientes:
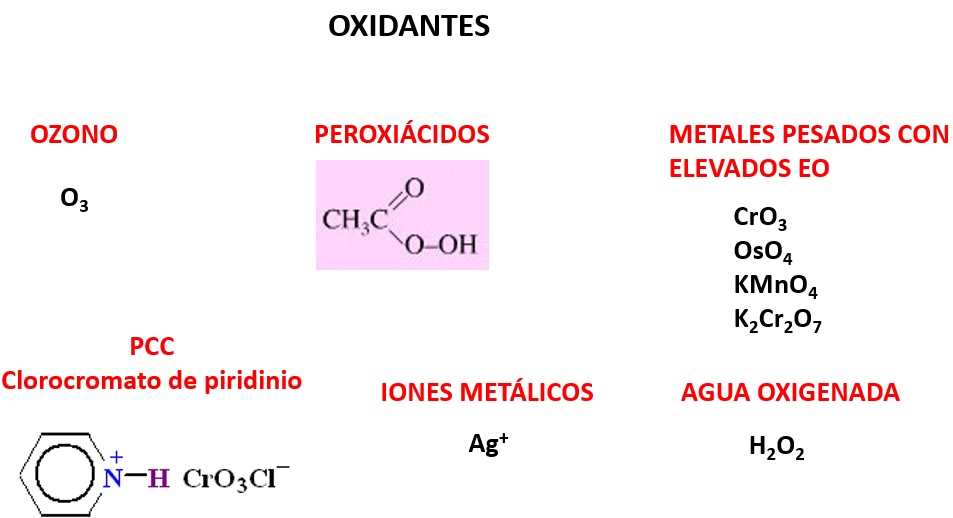
Los elementos no metálicos con elevada electronegatividad son por naturaleza agentes oxidantes:
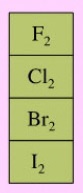
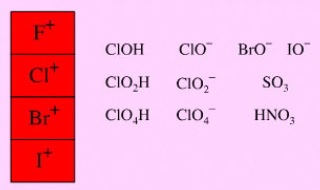
Los halógenos ganan con facilidad electrones disminuyendo nu número de oxidación. De manera similar, las especies químicas ricas en oxígeno, son oxidantes típicos en Química Orgánica. Entre ellas tenemos ozono, peróxido de hidrógeno o peroxiácidos.
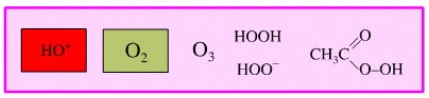
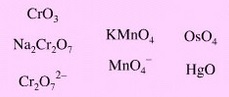
Otra fuente de especies oxidantes contienen no metales o metales en elevados estados de oxidación.