REACCIONES REDOX
EN ALQUENOS
OXIDACIÓN EN ALQUENOS
Los pricipales procesos de oxidación de los alquenos son los tres siguientes:

La ruptura oxidativa se puede conseguir usando ozono en lugar de permanganato, entonces el proceso se conoce como ozonólisis.

Al igual que cuando se usa permanganato, al final se obtiene una mezcla de productos que depende de la naturaleza (oxidativa o reductora) del segundo paso del proceso.
EPOXIDACIÓN
Los peroxiácidos son reactivos utilizados en la oxidación de alquenos. Los más comunes son los siguientes:

Los ácidos peroxicarboxílicos son sustancias inestables que tienen la característica única de poseer un átomo de O electropositivo. En estas sustancias el enlace O-O se puede romper don facilidad, por ejemplo, por interacción con el doble enlace de los alquenos.

El resultado de la reacción es un epóxido

El mecanismo tiene lugar en una sola etapa

La reacción es iniciada por el acercamiento del O electrofílico del ácido al doble enlace C=C nucleofílico. El mecanismo incluye una reacción concertada con un estado de transición circular de cinco miembros. El resultado final es que el O electrofílico del ácido es transferido al alqueno para formar el epóxido, regenerándose el ácido carboxílico.
En esta reacción la regioselectividad no es relevante ya que se forman dos enlaces C-O iguales, sin embargo, la estereoquímica es syn ya que los dos enlaces C-O se forman por la misma cara del alqueno. Como la reacción es concertada, la estereoquímica del alqueno se conserva en el producto.


La reacción es muy selectiva, aumentando la posibilidad del ataque sobre el alqueno a medida que aumenta su grado de sustitución. Esto refleja el aumento del grado de nucleofilia del alqueno a causa del efecto de donación de carga de los sustituyentes alquilo.

La reacción de epoxidación tiene lugar en un disolvente no acuoso como cloroformo, éter, dioxano, acetona o diclorometano ya que la presencia de agua provocaría la apertura del epóxido. Este hecho puede ser interesante en algunos casos, cuando se desean obtener glicoles anti.
La hidrólisis del glicol es anti a causa de factores estéricos. El anillo es atacado por el lado opuesto al átomo de oxígeno existente. Por lo tanto, si el alqueno de partida es trans el diol vecinal resultante tendrá un estereocentro S y otro R. Pero si el alqueno de partida es cis, el diol vecinal resultante será una mezcla racémica de los enantiómeros S,S y R,R.

HIDROXILACIÓN
El tetraóxido de osmio y el permanganato de potasio pueden ser utilizados para oxidar alquenos produciendo dioles vecinales (glicoles) syn.

El permanganato de potasio (básico) y el tetraóxido de osmio en piridina son los reactivos utilizados para la dihidroxilación de los alquenos. Ambas reacciones parecen proceder por el mismo mecanismo, una primera fase de ataque electrofílico sobre el alqueno en la que se mueven tres pares de electrones simultáneamente para formar un metalociclo (éster) en el que el átomo metálico ocupa el centro de un tetraedro de átomos de oxígeno y, una segunda fase, de reducción de ese éster cíclico. En esta fase, en el caso del OsO4 se utiliza H2S o NaHSO3.

Por ejemplo:

La reacción es un proceso concertado que produce la dihidroxilación anti del alqueno (complementaria de la epoxidación-hidrólisis que produce glicoles anti). Para ayudar a entender el mecanismo se dispone de la siguiente simulación:
La reacción puede dar lugar a estereocentros en el producto, en este caso los alquenos cis producen un producto meso y los alquenos trans producen una mezcla racémica de enantiómeros (al contrario que la epoxidación).

RUPTURA OXIDATIVA
Hay sustancias como los glicoles, alquenos y alquinos que pueden sufrir la ruptura de enlaces C-C formándose nuevos enlaces C-O.
En el caso de los glicoles, cuando son tratados con NaIO4 (periodato de sodio) el enlace de C-C entre los dos grupos OH se rompe y se forman nuevos enlaces C=O, dando lugar a aldehidos o cetonas en función de la estructura inicial del glicol.

La siguiente simulación puede ayudar a entender el mecanismo
Teniendo esto en cuenta, podrían utilizarse los procesos de epoxidación-hidrólisis y hidroxilación para obtener glicoles que posteriormente pueden sufrir ruptura oxidativa con NaIO4.
Sin embargo, es posible una ruptura oxidativa directa de alquenos si se utilizan oxidantes más potentes que los utilizados en la epoxidación y la hidroxilación. Como veremos, el uso de permanganato en medio ácido o de ozono, permite una oxidación intensa del alqueno que da lugar a la ruptura del doble enlace C=C y a la formación de compuestos carbonílicos (aldehidos o cetonas) y ácidos carboxílicos.
CON PERMANGANATO
Cuando el permanganato es utilizado en medio básico (pH>8) la oxidación de un alqueno alcanza el glicol (hidroxilación), pero cuando se hace en medio ácido en caliente se consigue la ruptura de la molécula del alqueno a la altura del doble enlace. Entonces se forman cetonas y/o aldehidos. En este último caso, a causa de las condiciones del medio de reacción, el aldehido se oxida hasta ácido carboxílico. Globalmente, por tanto, la ruptura oxidativa con permanganato en medio ácido produce cetonas y ácidos carboxílicos.

Cuando la ruptura oxidativa afecta a un alqueno terminal se produce CO2

La ruptura oxidativa con KMnO4 empieza con una adición al enlace pi formando un intermedio cíclico que se rompe para formar aldehidos o cetonas. Posteriormente los aldehidos se oxidarán a ácidos caroxílicos.

CON OZONO
El tratamiento del alqueno con ozono produce un ozónido, que posteriormente, en una segunda etapa, es descompuesto en un tratamiento oxidante o reductor. El primero produce cetonas y ácidos carboxílicos y el segundo cetonas y aldehidos ya que en el medio de reacción estos últimos no se oxidan.
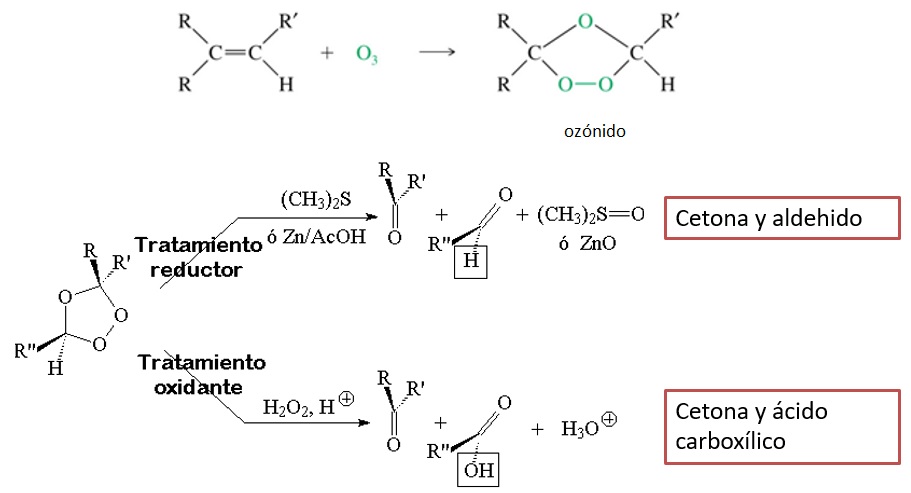
Por ejemplo:


La etapa final reductora puede llevarse a cabo con Zn/ácido o bien con dimetil sulfuro Me2S

El mecanismo del tratamiento final oxidante con peróxido de hidrógeno es el siguiente:

Po su parte, durante el tratamiento reductor con dimetil sulfuro el átomo de azufre, bastante polarizable, induce una carga parcial positiva en uno de los dos átomos de oxígeno conectados rompiendo el débil enlace O-O.

La siguiente animación puede ayudar a entender el mecanismo
La ozonólisis permite convertir alquenos cíclicos en compuestos dicarboxílicos.

La ozonólisis ha sido usada para determinar la posición de los dobles enlaces en un alqueno múltiple. Basta conectar los compuestos carbonílicos por los enlace C=O.
Si el alqueno es complejo, la reacción da lugar a una mezcla de productos que hay que separar.

REDUCCIÓN DE ALQUENOS
La reducción de alquenos se consigue habitualmente por adición catalítica de hidrógeno. La adición de hidrógeno a alquenos es un proceso exotérmico que transforma un enlace doble C=C en dos enlaces simples C-H. Produce alcanos y, a pesar de su carácter exotérmico, no ocurre sin catalizador a causa de su elevada energía de activación. Los catalizadores habitualmente utilizados son sólidos metálicos como Pd-C ; PtO2 o Ni. En este proceso la regioquímica no es relevante porque los dos átomos unidos al doble enlace son iguales, sin embargo, la estereoquímica es SYN. Esto es consecuencia del mecanismo de actuación del catalizador que necesita de la adhesión a los reactivos a su superficie, siendo necesario que los dos átomos de H se unan al alqueno por la misma cara.

En la hidrogenación catalítica tanto alqueno como hidrógeno han de ser adsorbidos en la superficie del metal. Una vez adsorbidos, los átomos de hidrógeno se unen a los átomos de carbono del doble enlace C=C por la misma cara. Completado el proceso se produce la desorción.

La hidrogenación catalítica es, por tanto, un proceso estereoespecífico





