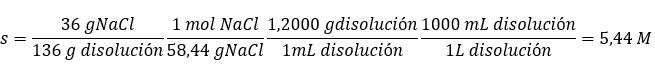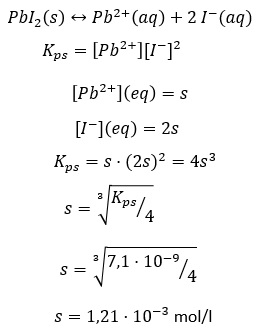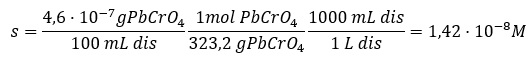|
||
SOLUBILIDAD Y PRODUCTO DE SOLUBILIDAD |
||
INDICE |
||
PRODUCTO DE SOLUBILIDAD
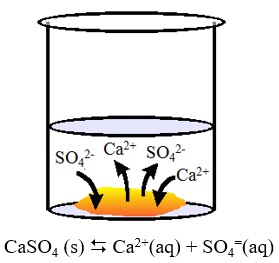
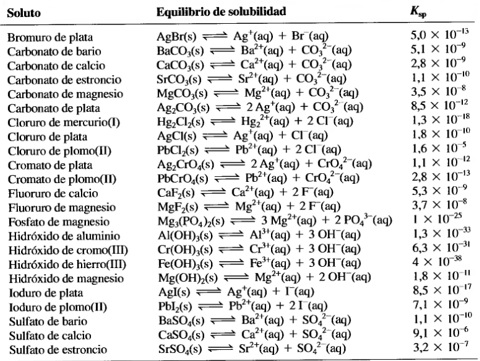
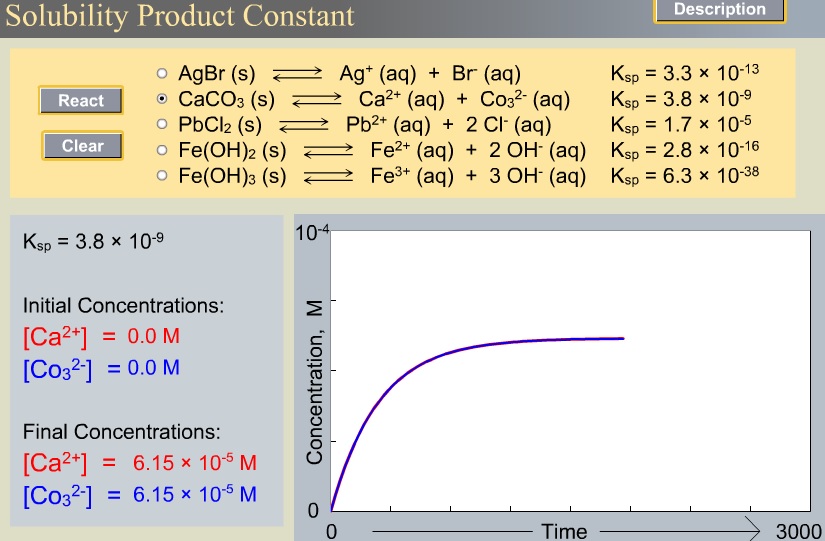
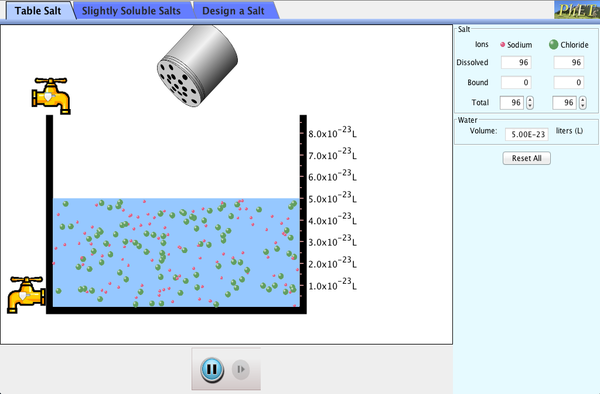
El sulfato de calcio es una sustancia poco soluble en agua. Esto significa que cuando añadimos este sólido al agua, la mayor parte de él permanece sin disolverse en el fondo del vaso y solo una pequeña parte se disuelve en el agua formando una disolución saturada. Esta disolución (saturada pero muy diluida) que contiene los iones Ca2+ y SO42- , se encuentra en equilibrio con el sulfato de calcio no disuelto.Este equilibrio, como otros que hemos visto, es dinámico. Eso quiere decir que continuamente hay sulfato de calcio pasando a la disolución e iones sulfato y calcio combinándose y pasando al sólido no disuelto. Ambos procesos: disolución y cristalización, ocurren con la misma velocidad. La constante de este equilibrio entre un sólido poco soluble y sus iones en disolución se denomina constante del producto de solubilidad (Kps).Para el sulfato de calcio se cumple:Kps = [Ca2+]eq [SO42-]eq = 9,1·10-6 (a 25 ºC).En esta constante Kps, las concentraciones de iones calcio y sulfato son las de equilibrio entre la disolución saturada y el sólido sin disolver. Si utilizáremos las concentraciones de cualquier otro estado del sistema ya no sería Kps sino, como sabemos, el cociente de reacción Q conocido como Producto Iónico.Q = [Ca2+] [SO42-]En la siguiente tabla se recoge la constante del producto de solubilidad de una serie de sustancias poco solubles en agua. Como puede comprobarse, sus valores son muy pequeños, indicando que en el equilibrio, las concentraciones de "productos", es decir, iones en disolución, han de ser muy pequeñas. |
||
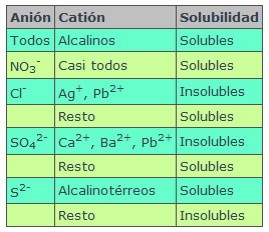
RELACIÓN ENTRE SOLUBILIDAD Y PRODUCTO DE SOLUBILIDADLa relación matemática entre la solubilidad y la constante del producto de solubilidad viene impuesta por la fórmula de la sustancia en cuestión. Supongamos una sustancia de fórmula AaBb poco soluble que ha alcanzado el equilibrio con sus iones en disolución: |
||
Limitaciones de KpsLa definición de la constante del producto de solubilidad asume que el sólido poco soluble se disocia en iones que son solvatados por moléculas de agua en el seno de la disolución. Esta asunción suele estar lejos de la realidad, porque los iones procedentes del sólido pueden interaccionar con otros iones presentes en el medio, por ejemplo, los iones hidronio e hidroxilo siempre presentes en agua, pueden sufrir reacciones redox, liberar gases, ...Las desviaciones observadas entre los datos experimentales y las solubilidades calculadas a partir de la constante del producto de solubilidad se deben a las siguientes razones: formación de pares iónicos (efecto salino), la disociación incompleta de solutos moleculares, la formación de iones complejos y cambios en el pH.Efecto salinoLa consecuencia práctica de este fenómeno es que un sustancia poco soluble puede aumentar su solubilidad por la presencia de iones que no participan en el equilibrio de solubilidad. Por ejemplo, el yeso (CaSO4) es poco soluble en agua pero se disuelve bastante mejor en agua salada. La presencia de iones cloruro y sodio mejora mucho su solubilidad. Parece un fenómeno nada intituito. ¿Por qué ocurre?.Parece ser que cuando las concentraciones iónicas no son pequeñas, los iones en la disolución, además de rodearse de moléculas de agua (solvatación), también tienden a rodearse de iones de signo contrario (se forma un par iónico). Cuanto mayor es su carga más intenso es este efecto. De esta manera, mediante la asociación de iones de distinto signo, lo que se está produciendo es una disminución del número de iones en el seno de la disolución. O sea, está disminuyendo la concentración real o efectiva de los iones. En este contexto ya no son válidas las relaciones entre Kps y concentraciones.
Para solventar el problema y seguir manteniendo el concepto de Kps, se definieron nuevas magnitudes que, en estos casos, sustituían a la concentraciones. Son las denominadas actividades. La actividad se calcula multiplicando la concentración por un factor de actividad. Este factor tiende a valer 1 cuando la disolución es muy diluida.Ahora se entiende que el equilibrio de disolución solo se aplique a sales poco solubles. En ellas las disoluciones saturadas son muy diluidas y no se presentan los problemas que se han descrito anteriormente. Las concentraciones de los iones son suficientemente pequeñas como para que no se produzcan asociaciones de iones. Las disoluciones saturadas de las sales solubles son disoluciones concentradas y en ellas se produce la formación de pares iónicos y el alejamiento del comportamiento ideal descrito por la constante del producto de solubilidad.Para cuantificar este efecto se introdujo el concepto de fuerza iónica (µ):
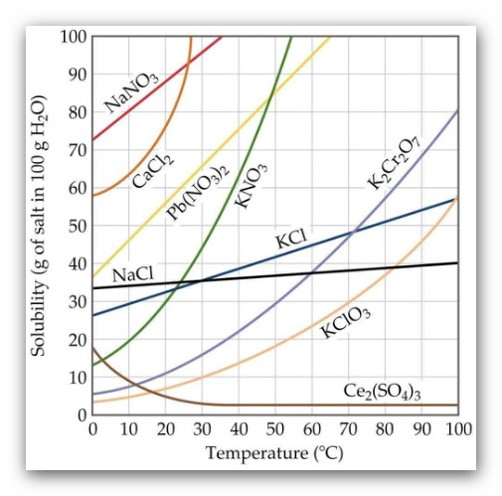
El estudio de la fuerza iónica de una disolución fue iniciado por Lewis y Randall en 1921 para describir los coeficientes de actividad de los electrolitos fuertes. La teoría de Debye-Huckel predice que la presencia de un segundo electrolito modifica la fuerza iónica de la disolución y disminuye el coeficiente de actividad del electrolito primario. Se podría decir que una disminución de las actividades (concentraciones reales) de los iones obliga a una mayor disolución de la sal primaria para cumplir la constante del producto de solubilidad.La siguiente figura compara el efecto salino con el efecto del ion común. El primero provoca un aumento de la solubilidad, el segundo una disminución.
|