ESTRUCTURA Y PROPIEDADES
AMINAS

Las aminas pueden considerarse como derivados del amoniaco. Pueden ser primarias, secundarias o terciarias dependiendo del núero de cadenas carbonadas unidas al nitrógeno.

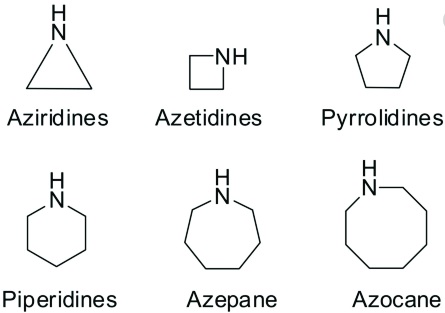
Hay compuestos con más de un grupo amino, por ejemplo el diamino metano: H2N-CH2-NH2. También hay aminas cíclicas en las que el nitrógeno está incluido en un anillo, convirtiéndose en una amina secundaria o terciaria, por ejemplo:
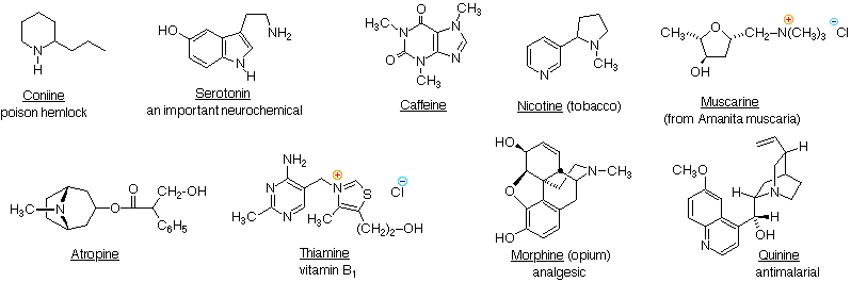
De manera natural las aminas están presentes en proteínas, vitaminas, hormonas, ...
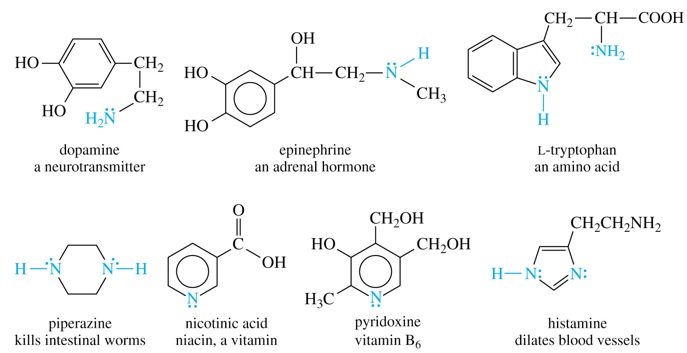
Hoy día las aminas tienen grandes aplicaciones. Purificación de agua, manufactura de medicinas, insecticidas y pesticidas. Producción de aminoácidos y vitaminas.
ESTRUCTURA
El átomo de nitrógeno de las aminas tiene hibridación sp3
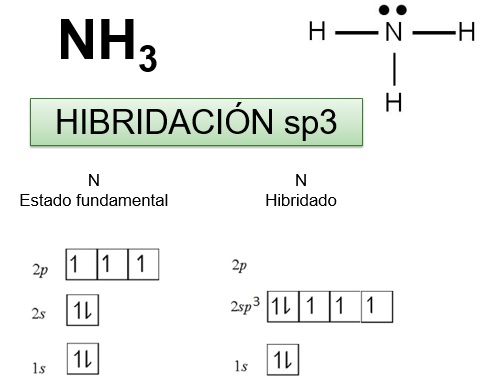
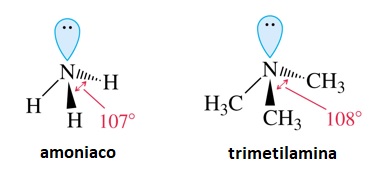
La molécula de amina son piramidales, con un par de electrones ocupando un orbital híbrido sp3 no enlazado.
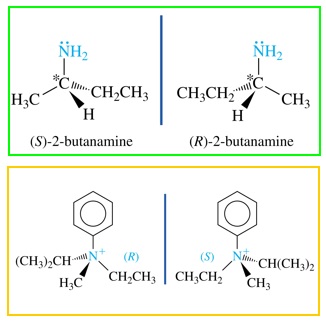
Esta estructura permite que, si los tres sustituyentes son distintos, la molécula de amina podría presentar quiralidad. Sin embargo, la interconversión entre configuraciones R y S es tan rápida a temperatura ambiente que no se han podido separar.
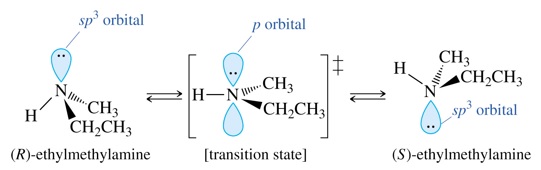
Las aminas pueden ser quirales
PROPIEDADES FÍSICAS
Las aminas son polares y pueden formar puentes de hidrógeno. Esto provoca que se an sustancias con altos puntos de fusión y ebullición y que, además, tengan buena solubilidad en agua.

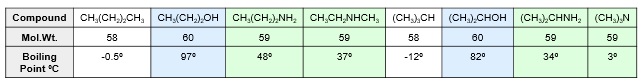
La siguiente tabla muestra que los puentes de hidrógeno en los alcoholes son más fuertes que en las aminas. Por ello, los puntos de ebullición de los alcoholes son mayores que los de las aminas de similar masa molecular.
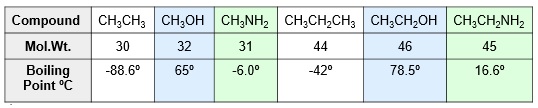
Por otra parte, al pasar de aminas primarias a secundarias y terciarias hay una disminución en los puntos de ebullición debido a que se pueden formar menor número de puentes de hidrógeno.
La solubilidad en agua de las aminas es similar a la de los alcoholes de un número comparable de carbonos. La solubilidad de las aminas terciarias es similar a las de los éteres. Además, hay que considerar que la basicidad de las aminas permite que sean disueltas en ácidos minerales diluidos.
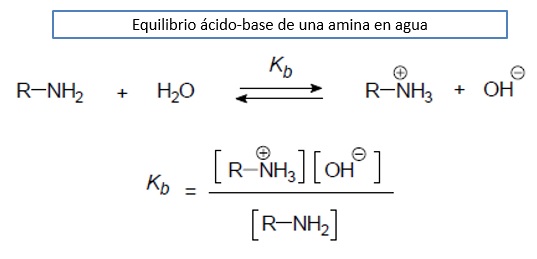
Las aminas presentan un comportamiento moderadamente básico.
Las aminas alifáticas son más básicas que las aminas aromáticas
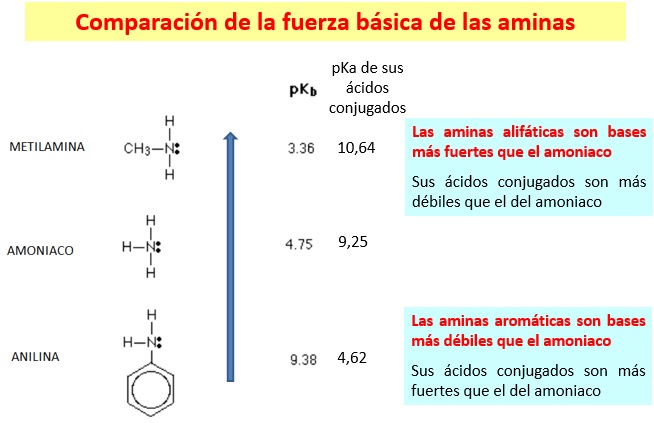
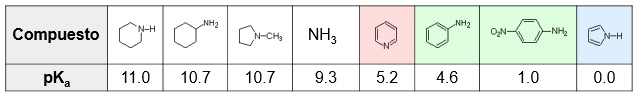
En el caso de las aminas alifáticas el ion amonio se estabiliza por la cesión de carga de las cadenas carbonadas unidas al N
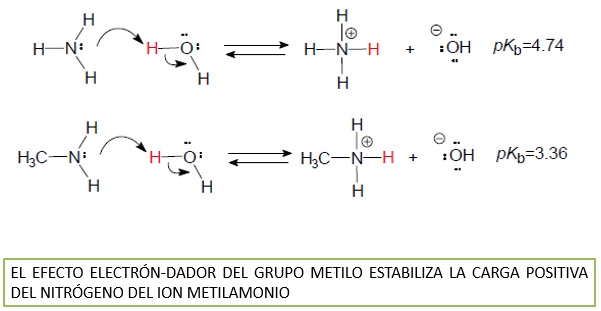
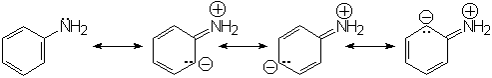
En el caso de las aminas aromáticas, la disminución de la basicidad se debe a que el par de electrones del N no está tan disponible como en las aminas alifáticas porque se comparten con el anillo por efecto resonante.