REACCIONES REDOX
EN ALDEHIDOS Y CETONAS
OXIDACIÓN DE ALDEHIDOS Y CETONAS
La presencia de un H unido al grupo carbonilo permite que los aldehidos puedan oxidarse con facilidad. Por el contrario, la ausencia de tal H en las cetonas hace que estas sustancias sean refractarias a la oxidación salvo que se rompa su estructura carbonada.
El carbono del grupo carbonilo presenta un elevado estado de oxidación, por ello, en la mayor parte de las reacciones en las que participa o bien conserva su grado de oxidación o lo reduce (por ejemplo, formación de alcoholes). El proceso de oxidación típico de los compuestos carbonílicos (aldehidos) es el que los conduce a ácidos carboxílicos.
En los procesos de oxidación de los alcoholes primarios y secundarios tuvimos ocasión de describir que diversos reactivos como ácido crómico, permanganato de potasio o hipoclorito de sodio son capaces de oxidar los aldehidos hasta ácidos carboxílicos por medio de la formación de los hidratos correspondientes. Además de ellos, el óxido de plata también provoca la oxidación de los aldehidos.

Entre las reacciones de oxidación específicas de los aldehidos se encuentra la conocida como reacción del espejo de plata (reacción de Tollens). El reactivo de Tollens contiene el ion diaminplata (I) que sufre reducción frente al aldehido (las cetonas no dan esta reacción). La reacción redox es la siguiente:

De acuerdo con el mecanismo propuesto, el grupo carbonilo es oxidado por un ion plata resultando un ion radical que reacciona con el ion hidroxilo (medio básico) para formar un intermedio tetraédrico. Un desplazamiento de H en él provoca la formación de un gem-diol que reacciona con otro grupo hidroxilo y es oxidado por otro ion plata para dar finalmente el ion carboxilato.
El resultado positivo en el test de Tollens se aprecia por la formación de una capa de plata (espejo) en el recipiente de reacción.

En los test de Fehling y Benedict se utiliza el catión Cu (II) como oxidante. En este caso el cobre es reducido hasta Cu2O que precipita como un sólido amarillo.
La oxidación de las cetonas pasa por la ruptura de un enlace C-C. En el caso de usarse oxidantes fuertes como ácido crómico o permanganato en medio ácido en caliente, el resultado son dos ácidos carboxílicos. Si se utiliza un oxidante más suave como perácidos carboxílicos (Oxidación de Baeyer-Villiger) se obtiene un éster que puede ser hidrolizado hasta formar una mezcla de alcohol y ácido carboxílico.

Un ácido comunmente usado en la reacción de Baeyer-Villiger es el meta-cloroperoxibenzoico (mCPBA).

El mecanismo es el siguiente:

REDUCCIÓN DE ALDEHIDOS Y CETONAS

Los procesos de reducción más importantes que afectan a los compuestos carbonílicos son los siguientes:
- Hasta alcoholes: Hidrogenación catalítica o reducción con hidruros
- Hasta alcanos: Reducción de Clemmensen (Zn/HCl) o reducción de Wolf-Kishner (H2NNH2/OH)
REDUCCIÓN HASTA ALCOHOL
Hidrogenación catalítica

El mecanismo es una adición cys.
Reducción con hidruros
Los hidruros más utilizados en estas reducciones son los siguientes hidruros complejos:
- Borohidruro de sodio BNaH4
- Hidruro de litio y aluminio LiAlH4
Como el aluminio es menos electronegativo que el boro, el enlace Al-H en LiAlH4 es más polar, por tanto, este hidruro es más fuerte como reductor (libera con más facilidad inones hidruro). Ambos reducen aldehidos y cetonas pero solo el de litio y aluminio consigue reducir ácidos carboxílicos y ésteres.
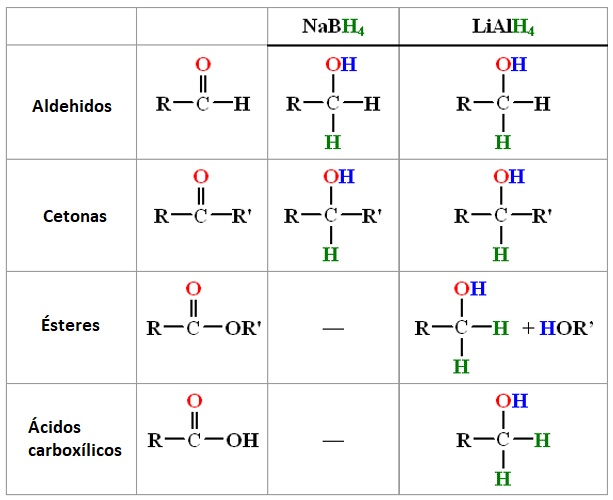
La menor reactividad del borohidruro de sodio puede ayudar en ciertos procesos de síntesis.

La adición de un ion hidruro a un aldehido o una cetona produce un ion alcóxido que, por protonación, produce el correspondiente alcohol. Los aldehidos producen alcoholes primarios y las cetonas alcoholes secundarios.

El mecanismo es el siguiente:

Si se forma un carbono asimétrico el producto final será una mezcla racémica

Ejemplos:

Como la sal del alcóxido formado es insoluble necesita ser hidrolizada. Cuando se usa borohidruro de sodio, la presencia de metanol como solvente soluciona el problema. Cuando se usa hidruro de litio y aluminio se usa un segundo paso con agua.
REDUCCIÓN HASTA ALCANO
Reducción de Clemmensen
La reducción de Clemmensen consiste en la reacción de aldehidos o cetonas con una amalgama de Zn (Zn/Hg) finamente dividida en ácido clorhídrico concentrado. El Hg no participa de la reacción solo provee de una superficie de reacción.

El mecanismo de reacción no está completamente entendido. Lo más probable es que ocurra de la siguiente manera:

Reducción de Wolf-Kishner
Los aldehidos y las cetonas pueden ser convertidos en hidrazonas por reacción con hidracina. Por otra parte, las hidrazonas pueden ser convertidas en alcanos si se les hace reaccionar con una base en caliente. Ambas reacciones juntas forman la conocida reducción de Wolf-Kishner que es un proceso general para transformar compuestos carbonílicos en alcanos.

La combinación de los dos procesos es la reducción de Wolf-Kishner

El mecanismo de la reacción de la hidrazona con la base es el siguiente:

