
ESTRUCTURA Y PROPIEDADES
ALCOHOLES

Los alcoholes son compuestos en los que uno (o más) átomos de hidrógeno han sido sustituidos por un (o varios) grupo hidroxilo -OH.
Los alcoholes suelen ser clasificados según como el grupo -OH está posicionado en la cadena carbonada: primarios, secundarios y terciarios.

En los alcoholes primarios el carbono que porta el grupo -OH está unido a un solo grupo alquilo, en los secundarios a dos grupos alquilo y en los terciarios a tres grupos alquilo.
Los alcoholes de mayor interés industrial son metanol, etanol e isopropanol. Ellos, a su vez, suelen ser obtenidos mediante la hidratación de los alquenos obtenidos en el craking de naftas. En el proceso la hidratación se realiza en fase gaseosa sobre catalizadores ácidos, generalmente H3PO4 fijado sobre un soporte sólido de SiO2 o sobre una resina.
También son usados procesos de carbonilación. En este caso, el alcohol se obtiene por hidrogenación catalítica del aldehido obtenido al hacer reaccionar el alqueno con CO.

En el caso del etanol tiene importancia la producción a partir de la fermentación de azúcares.

En el caso del metanol, se sigue usando el proceso basado en el gas de síntesis

Los alcoholes se utilizan como productos químicos intermedios y disolventes en multitud de procesos industriales. Por ejemplo, el etanol es la materia prima de numerosos productos, como acetaldehído, éter etílico y cloroetano. Se utiliza como anticongelante, aditivo alimentario y medio de crecimiento de levaduras, en la fabricación de revestimientos de superficie y en la producción de gasolina (aumento del número de octanos). La producción de butadieno a partir de alcohol etílico ha tenido una gran importancia en las industrias de los plásticos y el caucho sintético. El alcohol etílico puede disolver muchas sustancias y, por este motivo, se utiliza como disolvente en la fabricación de fármacos, plásticos, lacas, barnices, plastificantes, perfumes, cosméticos,aceleradores del caucho, etc
ESTRUCTURA
La estructura de los alcoholes es similar a la del agua, reemplazando uno de los átomos de H por un grupo alquilo.

El ángulo H-O-H en el agua es de 104,5 º y el ángulo C-O-H en el metanol es algo mayor 108,9º a causa de la repulsión estérica provocada por el grupo metilo, de mayor volumen que el átomo H.
La hibridación del átomo de C y del átomo de O en los alcoholes es sp3.
PROPIEDADES FÍSICAS
El siguiente gráfico compara los puntos de ebullición de cuatro alcoholes primarios (metanol, etanol, 1-propanol y 1-butanol) con los de cuatro alcanos de similar estructura.

Los puntos de ebullición de los alcoholes son mayores que los de los alcanos con igual número de átomos de carbono. Esto es consecuencia de las intensas fuerzas intermoleculares que se establecen entre las moléculas de los alcoholes: fuerzas de Van der Waals (interacciones dipolo-dipolo) y puentes de hidrógeno. Las primeras como resultado de la polaridad de estas sustancias y los segundos por la presencia de enlaces O-H junto a pares de electrones no compartidos.

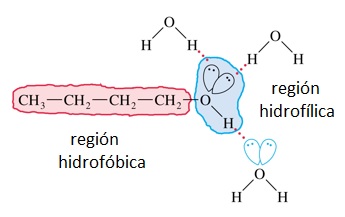
Los alcoholes pequeños son muy solubles en agua porque las interacciones entre las moléculas de ambas sustancias son muy parecidas: fuerzas de Van der Waals y puentes de hidrógeno.

Sin embargo, a medida que la cadena carbonada aumenta de longitud, la solubilidad disminuye. Esto es consecuencia de que la cadena de carbonos es hidrofóbica y responde a otro tipo de interacciones. El OH final del alcohol puede formar puentes de hidrógeno con moléculas de agua pero la "cola" carbonada no puede hacerlo.

Los alcoholes son ácidos débiles de Bronsted con pKa entre 15 y 20. Como el protón del grupo hidroxilo es el lugar más electrofílico, la transferencia de protón es una reacción a considerar cuando los alcoholes se encuentran en presencia de nucleófilos.

Como los alcoholes son ácidos débiles, necesitan de bases fuertes para que el equilibrio ácido-base esté significativamente desplazado hacia el ion alcóxido. Como vemos, la constante de equilibrio de la reacción entre metanol y hidróxido de sodio es pequeña (próxima a 1), sin embargo, aumenta hasta 1020 en presencia de iones amiduro.

Aunque destaquemos el carácter ácido de los alcoholes, no se puede olvidar que también pueden actuar como bases gracias a los pares de electrones no compartidos presentes en el átomo de oxígeno del grupo hidroxilo. De hecho, en muchas reacciones químicas se forman intermedios que son alcoholes protonados. Los alcoholes son, por tanto, sustancias anfóteras.

La fuerza como ácido del alcohol está relacionada con la estabilidad del ion alcóxido que se forma con la pérdida del protón. Cuanto más estable sea el ion alcóxido, más ácido será el alcohol. En este sentido hay que tener en cuenta que, a su vez, la estabilidad del ion alcóxido depende de la intensidad de alcance el proceso de solvatación con moléculas de agua. Iones pequeños, poco impedidos, como el metóxido se solvarán con mucha facilidad. Por el contrario, otros como el tert-butóxido tienen mucha dificultad para que las moléculas de agua se le acerquen.

Como resultado, los alcoholes más ácidos son los primarios y los menos ácidos los terciarios.

Hay que tener en cuenta que los alcoholes aromáticos (fenol) son más ácidos que los alcoholes alifáticos. En el caso del fenol, pKa = 10. Esto es consecuencia de la estabilidad del ion fenóxido, conseguida por efecto resonante. La carga negativa del oxígeno se reparte entre tres de los carbonos del anillo bencénico.

