ESPECTROSCOPÍA
ULTRAVIOLETA-VISIBLE
¿CÓMO FUNCIONA UN ESPECTROFOTÓMETRO UV?
Para entender el funcionamiento de un espectrofotómetro UV puede emplear esta animación:
Haciendo click sobre la imagen se inicia la animación. Úsela para identificar en el aparato los siguientes dispositivos:
1.- Fuente estable de energía radiante (lámpara de deuterio o de arco de xenón)
2.- Recipiente transparente para la muestra (de cuarzo o plástico en el visible)
3.- Dispositivo que aisle la región de interés en el espectro (monocromador de prisma o red)
4.- Detector de radiación que la convierta en señal eléctrica (fotomultiplicador)
5.- Sistema de tratamiento o lectura de la señal
ESPECTROSCOPÍA: ORIGEN DEL PROBLEMA
ESPECTROSCOPÍA ULTRAVIOLETA-VISIBLE
ESPECTROS IR DE SUSTANCIAS ORGÁNICAS
CONSTRUYENDO UN ESPECTRO UV
Una vez entiende el funcionamiento de un espectrofotómetro UV, ha llegado el momento de usarlo. Es la mejor manera de entender las características y limitaciones de esta técnica.
Haciendo click sobre la siguiente imagen podrá acceder a una animación interactiva de un espectrofotómetro UV.
Úsela para construir el espectro de las especies CoCl4-2 y Co(H2O)6+2
Instrucciones:
-
Haga click sobre la tapa del espectrofotómetro (se abrirá)
-
Arrastre la cubeta con muestra hasta colocarla en el aparato
-
Cierre la tapa haciendo click sobre ella
-
Abra la tapa y quite la cubeta (click)
-
Seleccione otra longitud de onda (empiece con intervalos de 50 nm) hasta completar todo el intervalo. Identifique la longitud de onda para la que se produce el máximo de absorción
-
La animación le construye automáticamente el gráfico
-
Repita todos los pasos con la otra sustancia
LA ESPECTROFOTOMETRÍA UV PARA IDENTIFICAR GRUPOS FUNCIONALES
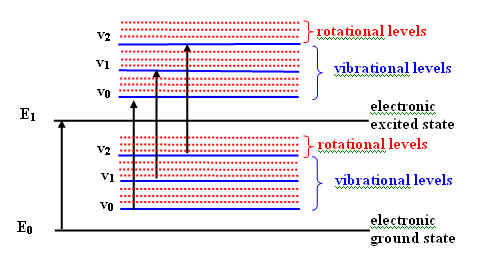
La absorción de radiación ultravioleta o visible provoca la excitación de los electrones de enlace y, en consecuencia, los picos de absorción pueden relacionarse con los tipos de enlace que existen en las especies en estudio. La espectroscopía UV es, por tanto, valiosa para la identificación de los grupos funcionales de una molécula, sin embargo presenta una gran limitación:
La energía usada (UV) para excitar los electrones también provoca cambios vibracionales y rotatorios
Al solaparse los saltos electrónicos con los vibracionales y rotatorios la consecuencia es un espectro continuo con picos anchos en forma de campana y, por tanto, difícil de interpretar. A pesar de ello el espectro UV puede dar información de la presencia o ausencia de determinados grupos funcionales (cromóforos) en los compuestos orgánicos.
Para entender el uso cualitativo de la espectrofotometría UV es necesario referirnos someramente a la teoría del orbital molecular.
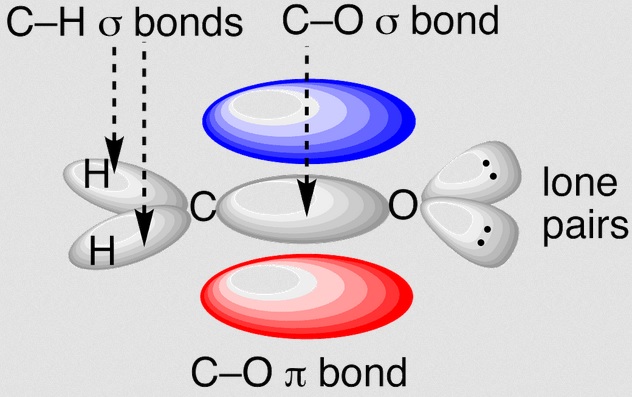
En los compuestos orgánicos nos encontramos con tres “tipos” básicos de electrones. Los que están involucrados en orbitales moleculares σ (sigma) (enlaces sencillos C-C), en orbitales moleculares π (pi) (enlace doble C=C) y los electrones no compartidos. En la molécula de formaldehido podemos distinguirlos claramente.
Los niveles energéticos de estos orbitales moleculares no son idénticos y cuando irradiamos la muestra con luz UV se producen tránsitos electrónicos desde niveles de menor energía hasta niveles de mayor energía. En general la distribución energética de los OM es como la indicada en la siguiente figura
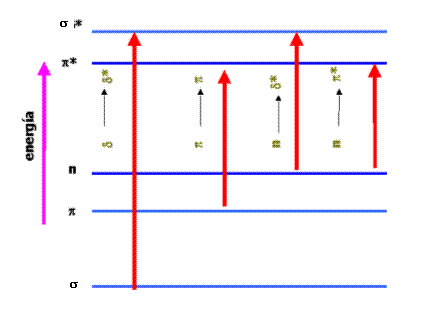
En base a ella vamos a distinguir tres casos:
a) Moléculas como el metano que sólo tienen electrones σ
La energía necesaria para que se dé el tránsito desde el orbital enlazante σ al antienlazante σ * es muy grande, se necesita por tanto radiación de alta energía (frecuencia) o lo que es lo mismo baja longitud de onda. En el caso del metano el máximo de absorción de produce a 125 nm. Esa es la zona del ultravioleta de vacío (<185 nm) demasiado lejana y poco útil. El etano que se encuentra en una situación similar absorbe también en la misma zona del espectro (135 nm)
b) Moléculas como el agua con electrones σ y electrones no compartidos
La transición electrónica que se produce es n → σ * . Esta situación es típica de compuestos orgánicos saturados con electrones no enlazados (procedentes de heteroátomos). En este caso el salto energético es menor que antes y suele producirse entre 150 y 250 nm, siendo lo habitual por debajo de 200 nm.
c) Moléculas con electrones π deslocalizados (alquenos, aromáticos, carbonilos, ....) y electrones no compartidos
En estos casos se producen transiciones electrónicas desde el orbital enlazante π hasta el orbital antienlazante π* y desde el orbital de electrones no enlazados n hasta el orbital antienlazante π*. En ambos casos los orbitales están separados por menos energía que los de casos anteriores y, en consecuencia, la energía de la radiación UV que provoca el tránsito ha de ser menor (también lo será la frecuencia) y la longitud de onda mayor. Son las transiciones más importantes ya que las energías requeridas caen plenamente dentro de la región UV (200-700 nm). Ambas transiciones requieren de grupos que suministren orbitales π , centros absorbentes insaturados denominados cromóforos.
Los datos de las tablas deben tomarse sólo como guía ya que la posición de los máximos viene muy afectada por el disolvente y los picos son muy anchos debido a los comentados efectos vibracionales.
|
Sólo las moléculas que tienen electrones π o heteroátomos con pares de electrones de valencia no enlazados absorben luz en la región de 200-800 nm (cromóforos).
La conjugación de cromóforos tiene un acusado efecto sobre las propiedades espectrales, cuanto mayor sea el número de insaturaciones mayor será el desplazamiento del pico de absorción hacia menores longitudes de onda (hacia el visible)


El naftaleno y el antraceno son incoloros. El tetraceno es naranja
LA ESPECTROFOTOMETRÍA UV EN EL ANÁLISIS CUANTITATIVO
La aplicaciones de la espectroscopía UV en el análisis cuantitativo de los grupos que producen absorción es muy importante. Su aplicación se basa en la ley de Lambert-Beer.
Pequeña investigación: ¿qué relación existe entre la absorbancia A que mide el espectrofotómetro y la concentración c de la especie activa?
Plantee la hipótesis que le parezca más razonable entre ambas variables suponiendo que el resto (anchura de la cubeta, especie activa, ...) no cambian. A continuación realice la experiencia descrita usando el espectrofotómetro virtual que antes ha conocido. Por último, una vez analizados los datos obtenidos, compruebe si su hipótesis era correcta.
ABSORBANCIA Y TRANSMITANCIA
Hasta ahora nos hemos referido a diferentes conceptos sin aclararlos suficientemente, uno de ellos es la absorbancia. Intuitivamente lo asociamos a una medida de la radiación absorbida por la muestra, pero esa noción tan simple no es suficiente para comprender la ley de Lambert-Beer.
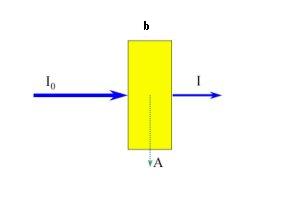
La absorbancia A es una magnitud que mide la capacidad de absorber radiación de una muestra a través de la siguiente relación:
A = log (Io / I)
asociada a ella, en ocasiones se usa la transmitancia T
T = I/Io
la relación entre ambas magnitudes es:
A = log (1/T) = -log T
La ley de Lambert-Beer indica que la intensidad de la radiación disminuye logarítmicamente a medida que longitud del paso óptico y la concentración aumentan aritméticamente. En otros términos podríamos decir que la absorbancia A es directamente proporcional a la anchura de la cubeta (b) y a la concentración de la muestra (c), siendo la constante de proporcionalidad (ε) un parámetro característico denominado absortividad.
A = ε b c
De esta forma, midiendo la absorbancia de una muestra podremos conocer, por ejemplo, la concentración del analito.