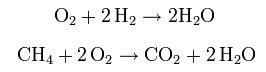|
 |
|
ECUACIÓN QUÍMICA |
||
LAS ECUACIONES QUÍMICAS REPRESENTAN LAS REACCIONES QUÍMICASEn las ecuaciones químicas aparecen las fórmulas y los coeficientes estequiométricos de reactivos y productos
En las ecuaciones químicas las sustancias moleculares están representadas por fórmulas moleculares. Las sustancias que no formen moléculas (por ejemplo aquellas que formen cristales iónicos o metálicos) se representan por sus fórmulas empíricas.Cl2 (g) + 2 Na (s) = 2 NaCl (s)En esta ecuación química, el cloro está representado por su forma molecular ya que en estado gaseoso se presenta en forma de moléculas diatómicas. Sin embargo, el sodio metálico y el cloruro de sodio están representados por fórmulas empíricas. En el caso del sodio porque en estado sólido se presenta en forma de átomos en un cristal metálico y, en el caso de cloruro de sodio, porque es estado sólido se presenta en forma de un cristal iónico en el que hay un ion sodio por cada ion cloro.Dado que la fórmula indica la composición de la sustancia, en ningún caso podrá ser modificada.Los coeficientes estequiométricos indican el número de partículas de reactivos y productos que intervienen en la reacción. Por ejemplo, según la ecuación anterior, una molécula de cloro se une a dos átomos de sodio y se producen dos unidades fórmula de cloruro de sodio. Si multiplicarámos por un número entero los coeficientes (por ejemplo, por dos) la ecuación química seguiría siendo válida.Existen infinitas combinaciones de coeficientes estequiométricos que son válidas para una ecuación química determinada. |
INDICE- Significado de las ecuaciones químicas - Interpretación de las reacciones químicas - Etapas en el cálculo estequiométrico - Estequiometría con reactivo limitante - Rendimiento de las reacciones químicas
|
|
AJUSTE DE LA ECUACIÓN QUÍMICALas ecuaciones químicas deben estar ajustadas (balanceadas), para ello hay que asegurar que en ambos miembros haya el mismo número de átomos de cada clase (Principio de Conservación de la materia). Para conseguirlo se modifican los coeficientes estequiométricos (nunca las fórmulas).Zn (s) + HCl (aq) = ZnCl2 (aq) + H2 (g) (Ecuación NO ajustada)2 Zn (s) + 2 HCl (aq) = ZnCl2 (aq) + H2 (g) (Ecuación SI ajustada)Cuando en la ecuación química intervienen iones, además de ajustar el número de átomos hay que ajustar la carga eléctrica. Hay que asegurar que la carga neta sea la misma en ambos miembros de la ecuación.H+ (aq) + NaHCO3 (s) = CO2 (g) + H2O (l) + Na+ (aq)- EL NÚMERO DE ÁTOMOS DE CADA TIPO DEBE SER IGUAL ANTES Y DESPUÉS DE LA REACCIÓN |