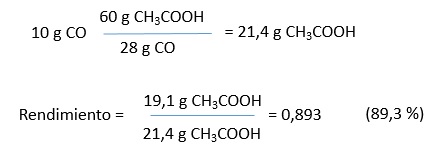|
 |
|
RENDIMIENTO DE LAS REACCIONES QUÍMICAS |
||
INDICE- Significado de las ecuaciones químicas - Interpretación de las reacciones químicas - Etapas en el cálculo estequiométrico - Estequiometría con reactivo limitante - Rendimiento de las reacciones químicas
|
||
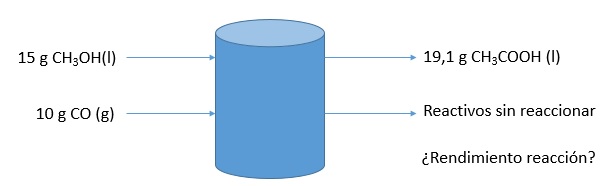
EJERCICIOLa reacción entre el alcohol metílico y el monóxido de carbono produce ácido acético. En una experiencia se usaron 15,0 g de metanol y 10,0 de monóxido de carbono, obteniéndose 19,1 g de ácido acético. Determinar:
Datos: Masas molares (g/mol) H 1,0 ; C 12,0 ; O 16,0 R = 0,082 atmL/molK |
||
Esquema |
||
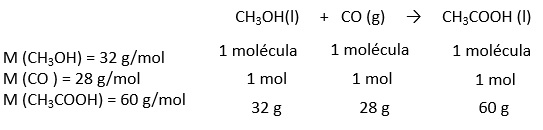
2.- Interpretación de la ecuación química |
||
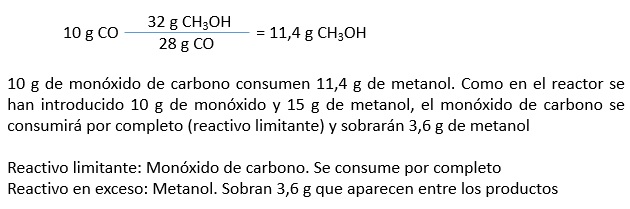
3.- Reactivo limitanteSi en el proceso químico intervienen más de una sustancia, una de ellas se consumirá antes que las demás. Este reactivo limitante condiciona la cantidad de producto obtenida. Los demás quedarán en exceso. En caso de que solo intervenga un reactivo, ese será el limitante. |
||
4.- Estrategia de cálculoAntes de hacer los cálculos tenemos que tener una estrategia para realizarlos. Habitualmente se obtendrá de la interpretación de la reacción química que hemos realizado en el paso 2. También es normal que haya que realizar cálculos auxiliares al principio y el final. |
||
5.- Cálculo de incógnitasEn general se realizan aplicando factores de conversión |
||
6.- ConclusiónSi se mezclan 10 g de monóxido de carbono y 15 g de metanol para producir ácido acético, el reactivo limitante es el monóxido de carbono, sobrando 3,6 g de metanol que aparecería mezclado con el ácido acético. En el caso de que esta reacción tuviera un rendimiento del 100 % se deberían obtener 21,4 g de ácido acético. Sin embargo, como solo se obtienen 19,1 g, la reacción no se completa y tiene un rendimiento del 89,3 %. |