
¿Qué son las burbujas que aparecen en el agua cuando hierve?
A.1. ¿Cuáles son los estados de agregación de la materia más comunes? ¿Qué implicaciones tiene la existencia de esos estados a nivel estructural?, es decir, ¿Cómo ha de ser la materia a nivel microscópico para que una misma sustancia pueda manifestarse de formas tan diferentes?
Habitualmente distinguimos entre los estados sólido, líquido y gaseoso. Cuando una sustancia pasa de uno a otro, las partículas materiales de las que está formada pueden juntarse o separarse, dando lugar a estructuras ordenadas (sólidos) o desordenadas (líquidos y gases) sin que cambie su naturaleza.

La existencia de diferentes estados de agregación en una misma sustancia se puede explicar muy bien asumiendo que la materia está formada por partículas que pueden estar unidas o separadas entre sí. En la imagen superior las bolas rojas representan las partículas de una sustancia, por ejemplo, agua. Serían moléculas de agua. El hecho de que las partículas estén separadas o fuertemente unidas entre sí, no afecta a su naturaleza. Las moléculas de agua no cambian por estar más menos próximas a otras moléculas de agua.
En los sólidos y los líquidos las partículas están muy próximas, sin embargo en los gases las partículas están muy separadas.
Eso tiene consecuencias: Los líquidos y los sólidos serán incompresibles y los gases, sin embargo, compresibles.
Si comprimimos un gas sus partículas podrán aproximarse ya que entre ellas hay mucho espacio vacío. Eso no ocurre en sólidos y líquidos.
En la siguiente simulación del CNICE podrá comprobarlo.
A.2. Teniendo en cuenta los estados de agregación más comunes de la materia, cite nombres y ejemplos de los cambios de estado que se pueden dar entre ellos.
Los cambios de estado más habituales son:
FUSIÓN:
PASO DE SÓLIDO A LÍQUIDO

Durante la fusión el agua sólida de un cubito de hielo pasa a agua líquida
SOLIDIFICACION:
PASO DE LÍQUIDO A SÓLIDO

Es el paso contrario al anterior. Cuando la temperatura es suficientemente baja se produce la solidificación del agua líquida
VAPORIZACIÓN:
PASO DE LÍQUIDO A GAS
PUEDE OCURRIR POR EVAPORACIÓN A CUALQUIER TEMPERATURA O POR EBULLICIÓN A LA TEMPERATURA DE EBULLICIÓN


En un lago el agua se evapora, solo las moléculas de agua de la superficie pasan a estado gas
En el recipiente colocado al fuego, cuando se alcanza la temperatura de ebullición, el agua comienza a hervir, es decir, en cualquier punto del líquido las moléculas de agua se separan entre sí y pasan a estado gas formando burbujas (se aprecian elevándose a través del líquido) (ojo: son burbujas de agua en estado gas, no son de aire).
CONDENSACIÓN:
PASO DE GAS A LÍQUIDO
En días fríos es habitual que observemos que en los cristales se forman gotas de agua sin que llueva. Eso también ocurre en el espejo del cuarto de baño.
SUBLIMACIÓN (y SUBLIMACIÓN INVERSA):
PASO DE SÓLIDO A GAS SIN PASAR POR LÍQUIDO
En este cambio de estado un sólido pasa directamente a gas sin pasar por líquido.
En la sublimación inversa ocurre todo lo contrario: un gas pasa a sólido sin convertirse en líquido previamente.
Estos procesos no son habituales en el agua, pero sí lo son en otras como el dióxido de carbono (hielo seco) o yodo.
- Estados de agregación de la materia
-Clasificación de la materia: sustancias puras y mezclas
- Métodos de separación de mezclas
- ¿Qué es un elemento químico (versión Lavoisier)?
OXÍGENO SÓLIDO - HIERRO GAS
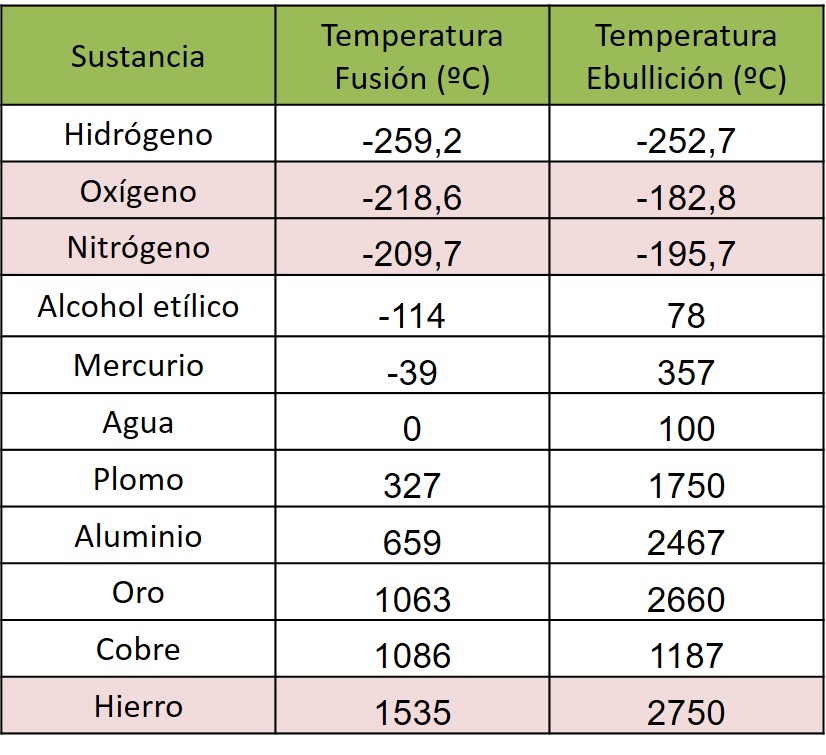
Aunque pueda sorprenderle, en general todas las sustancias pueden estar en los tres estados de agregación. El oxígeno, considerado como ejemplo de gas, puede licuar y solidificar. Efectivamente, podemos tener hielo de oxígeno y romperlo de un golpe como se hace con el hielo de agua. De igual modo, el hierro, considerado como ejemplo de sólido, puede licuar o vaporizar si las condiciones ambientales lo permiten.
A continuación tiene una tabla de puntos de fusión y ebullición, en ella podrá comprobar que (a presión 1 atm) el oxígeno es sólido por debajo de -218,6 ºC. Es una temperatura baja pero perfectamente alcanzable. De igual manera podrá comprobar que el oxígeno es un líquido entre -218,6 ºC y -182,8 C. Eso quiere decir que el oxígeno hierve a -182,8 ºC. Quizás le sorprenda que alguna sustancia pueda hervir a una temperatura tan baja. Normalmente asociamos hervir a temperatura elevada, pero eso no es cierto siempre.
El estado de agregación de una sustancia, por tanto, lo imponen las condiciones de presión y temperatura a las que esté sometida.
A.3. El hidrógeno está siendo considerado como posible combustible del futuro, sin embargo, por su naturaleza, presenta algunos inconvenientes muy serios ¿En qué intervalo de temperaturas existe hidrógeno líquido a la presión de 1 atm?
A la presión de 1 atm el hidrógeno líquido existe entre -252,7 ºC y -259,2 ºC. Esas son temperaturas extremadamente bajas, muy difíciles (caras) de alcanzar.
Para elevar la temperatura de ebullición del hidrógeno se puede aumentar la presión. Esto, sin embargo, obliga a trabajar a con presiones muy altas, algo muy peligroso.
Otro ejemplo es el del metano, que a la presión de 1 atm hierve a -161,6 ºC. Es el principal componente del gas natural y, en la Tierra, lo usamos como combustible gaseoso.
Sin embargo, eso no ocurre en Titán, uno de los satélites de Saturno. En él las condiciones ambientales permiten que el metano sea líquido. Allí existen mares de metano, incluso se produce lluvia de metano. Ver video.

TEMPERATURA Y ENERGÍA EN LOS CAMBIOS DE ESTADO
¿Qué ocurre con la temperatura durante los cambios de estado?
Como podrás ver en la siguiente simulación del CNICE, cuando una sustancia cambia de estado la temperatura se mantiene constante, no cambia.
Por eso, podemos decir que la temperatura de cambio de estado es una propiedad característica de una sustancia.
Por ejemplo, si manejamos un líquido que hierve a 78 ºC (a presión atmosférica) es muy posible que sea alcohol etílico.
¿Qué ocurre con la energía durante los cambios de estado?
Hay cambios de estado que absorben energía (endotérmicos) y otros que la liberan (exotérmicos).
La fusión (paso de sólido a líquido) y la vaporización (paso de líquido a gas) son endotérmicos. Se necesita un aporte de energía para romper las uniones entre las partículas de la sustancia.
Sin embargo la condensación (paso de gas a líquido) y la solidificación (paso de líquido a sólido) son exotérmicos. Se libera energía cuando las partículas de la sustancia se unen entre sí.
Con la siguiente simulación podrá calcular las necesidades energéticas durante el calentamiento del agua, desde estado sólido a estado gaseoso.
¿Qué consume mayor cantidad de energía: la fusión del hielo o la vaporización del agua?
Evidentemente, las necesidades energéticas guardan relación con las fuerzas que hay que vencer en los cambios de estado. En el paso de sólido a líquido las partículas continúan casi igual de próximas. Sin embargo, en el paso de líquido a gas, las partículas se separan completamente, debiendo superar las intensas fuerzas de atracción intermoleculares. En consecuencia: la entalpía de vaporización es siempre mayor que la entalpía de fusión.
DIAGRAMAS DE FASES
Un diagrama de fases muestra los estados de agregación de una sustancia en diferentes condiciones de presión y temperatura.
Líneas en el diagrama
Entre cada dos fases de una sustancia hay una línea que representa cómo varía la temperatura de cambio de estado con la presión. Una línea separa las regiones de sólido y líquido (temperatura de fusión), otra las de líquido y gas (temperatura de ebullición) y otra las de sólido y gas (temperatura de sublimación).
Puntos en el diagrama
En el punto triple coexisten las tres fases. En el punto crítico deja de existir diferencias entre las fases líquida y gasesosa.
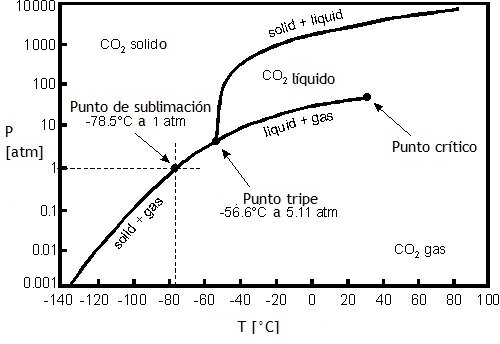
Por ejemplo, el siguiente diagrama de fases del agua muestra que a la presión de 1 atm el agua pasa de sólido a líquido a 0 ºC y que pasa de líquido a gas a 100 ºC (línea roja). Sin embargo, si la presión fuera inferior (como ocurre en lo alto de una montaña) el agua fundiría a una temperatura algo mayor que 0 ºC y herviría a una temperatura inferior a 100 ºC. El intervalo de temperaturas en las que existiría el líquido se estrecharía. De hecho, por debajo de una presión de 0,006 atm no existe el agua líquida, el agua sólida pasa directamente a gas (sublimación).
La necesidad de usar presiones tan bajas explica por qué en la Tierra no es frecuente la sublimación del agua. Eso no ocurre en otras condiciones o en otras sustancias (dióxido de carbono, yodo).

En los cráteres de la Luna que se encuentran en oscuridad permanente (polos) se ha encontrado agua sólida. Dada la inexistencia de atmósfera y una presión casi nula en su superficie, el agua lunar debe pasar directamente a gas, debe sublimar. Posteriormente, las moléculas de agua serían rotas por la radiación que barre la superficie.
El dióxido de carbono sólido (hielo seco) sublima en las condiciones existentes en la superficie terrestre. El dióxido de carbono líquido solo existe por encima de una presión de 5,11 atm.

EL CUARTO ESTADO DE LA MATERIA: PLASMA

El plasma es un estado de la materia que podríamos entender como un gas ionizado, es decir, un gas formado (en parte) por iones procedentes de átomos a causa del trasvase de electrones provocado, por ejemplo, por elevadas temperaturas. Es el estado de la materia más abundante a nivel universal. Las estrellas son bolas de plasma, formadas por las reacciones de fusión que ocurren en su centro.
La presencia de cargas eléctricas en el plasma, hace que se comporte de manera especial ante los campos magnéticos. Eso provoca la formación de arcos y penachos de plasma en torno a las líneas de campo magnético que salen de la superficie de la estrella. Para ver el Sol en tiempo real visitar el enlace de la NASA.
El plasma también puede ser formado por descargas eléctricas. En la Tierra tenemos ejemplos que se forman de manera natural: rayos y auroras boreales, o que se forman de manera artificial: tubos de luz fluorescente, pantallas de televisor de plasma, bolas de plasma, ...

ESTADOS EXÓTICOS DE LA MATERIA
Hoy día distinguimos entre estados de la materia de baja y alta energía. Entre los de baja energía están los clásicos que han sido comentados anteriormente, pero, además, existen otros como la materia fotónica, los fluidos supercríticos, los condensados Bose-Einstein o los condensados fermiónicos. En este video se citan 22 estados diferentes de la materia.









