

¿A qué huele una rosa?
¿y las violetas?

- Estados de agregación de la materia
-Clasificación de la materia: sustancias puras y mezclas
- Métodos de separación de mezclas
- ¿Qué es un elemento químico (versión Lavoisier)?
LO NATURAL Y LO SINTÉTICO
La mayoría de las personas piensan que lo "NATURAL"no tiene "QUÍMICA". Todavía no se han dado cuenta que el mayor y mejor químico que existe es la propia naturaleza. La Química está en todo lo que nos rodea. Si no lo crees, hazte las siguientes preguntas: ¿DE QUÉ ESTÁ HECHO UN PLÁTANO? ¿Y UN HUEVO?.


Plátanos y huevos están formados por una multitud de SUSTANCIAS QUÍMICAS PURAS. La más abundante es agua y, junto a ella, otras como la fructosa o la glucosa (AZÚCARES O HIDRATOS DE CARBONO) que aportan sabor dulce a la fruta. También hay aminoácidos (valina, arginina, leucina,...) que forman las PROTEÍNAS, o ácidos grasos que están presentes en lo que comunmente denominamos GRASAS.
EN DEFINITIVA, AL IGUAL QUE TODO LO QUE NOS RODEA, EL PLÁTANO O EL HUEVO SON MEZCLAS DE UN GRAN NÚMERO DE SUSTANCIAS QUÍMICAS PURAS.
QUÉ SON LAS SUSTANCIAS QUÍMICAS PURAS
Los químicos se llevaron mucho tiempo hasta descubrir la existencia de las sustancias químicas puras. Hasta finales del siglo XVIII y comienzos del siglo XIX no se aclaró el significado de este concepto estructural de la Química. El problema que había que resolver era complicado, nosotros lo formularemos con un ejemplo:
¿Es igual la composición del agua obtenida por evaporación del agua de mar o por combustión del hidrógeno? ¿Es igual la composición del agua obtenida de la orina, de la lluvia, o de un meteorito?
La respuesta es SI. El agua siempre tiene la misma composición sea cual sea la forma en que se obtenga. Siempre tendrá 1 g de hidrógeno por cada 8 g de oxígeno. Además siempre tendrá las mismas propiedades (por ejemplo, a la presión de 1 atm solidificará a 0ºC y hervirá a 100 ºC)
La forma de obtención de una sustancia pura no afecta a su composición.
o dicho de otra manera
Una sustancia pura siempre tiene la misma composición y propiedades
Esta afirmación que hemos hecho para el agua se puede hacer para todas las sustancias químicas puras. Por ejemplo, la glucosa, uno de los azúcares que encontramos en el plátano, lo podemos encontrar en infinidad de vegetales. En todos los casos tiene la misma composición: por cada 1 g de hidrógeno tiene 6 g de carbono y 8 g de oxígeno.
Estos dos ejemplos de sustancias puras, el agua y la glucosa, forman parte de las que denominamos COMPUESTOS. Así las diferenciamos de las que llamamos ELEMENTOS.
Como hemos visto los compuestos están formados por elementos en diferentes proporciones (el agua está formada por dos elementos: hidrógeno y oxígeno, sin embargo, la glucosa está formada por tres elementos: carbono, hidrógeno y oxígeno). Por el contrario, las sustancias puras denominadas ELEMENTOS no pueden descomponerse en nada más simple. En su composición solo hay una sustancia pura. En 1 g de oro solo hay 1 g de oro. En 1 g de hidrógeno solo hay 1 g de hidrógeno. Son poco más de cien: hidrógeno, oxígeno, oro, hierro, ...
LOS COMPUESTOS SON SUSTANCIAS PURAS QUE SE PUEDEN SEPARAR EN ELEMENTOS
LOS ELEMENTOS SON SUSTANCIAS PURAS QUE NO SE PUEDEN SEPARAR EN NADA MÁS SIMPLE
Elementos y compuestos forman lo que denominamos SUSTANCIAS QUÍMICAS PURAS.
Hay millones de compuestos y cada día se descubren nuevos

Solo hay unos pocos elementos. La tabla periódica indica los elementos conocidos

EN GENERAL, TODOS LOS MATERIALES QUE NOS RODEAN SON MEZCLAS DE SUSTANCIAS QUÍMICAS PURAS
UNA MEZCLA ES UN MATERIAL EN EL QUE COEXISTEN SIN COMBINARSE AL MENOS DOS SUSTANCIAS PURAS CUYAS PROPORCIONES PUEDEN CAMBIAR. LA COMPOSICIÓN DE LAS MEZCLAS CAMBIA DE UNAS MUESTRAS A OTRAS.
Al contrario que las sustancias químicas puras, la composición de una mezcla puede cambiar de unas muestras a otras. Por ejemplo, no todas las muestras de leche son iguales, unas contienen más grasa que otras. Lo mismo podríamos decir de los vinos o de las aguas embotelladas para el consumo humano.
Si los componentes de una mezcla SI se pueden diferenciar a simple vista la denominamos mezcla heterogénea (por ejemplo, el granito, donde podemos distinguir tres sustancias puras: cuarzo, feldespato y mica)
Si los componentes de una mezcla NO se pueden diferenciar a simple vista la denominamos mezcla homogénea (por ejemplo, la leche, donde, además de agua, encontramos azúcares, proteínas, grasas, ...)
LAS MEZCLAS HOMOGÉNEAS (disoluciones) TIENEN UNA COMPOSICIÓN IDÉNTICA EN TODOS SUS PUNTOS.
LAS MEZCLA HETEROGÉNEAS TIENEN COMPOSICIONES DIFERENTES EN ALGUNOS DE SUS PUNTOS.
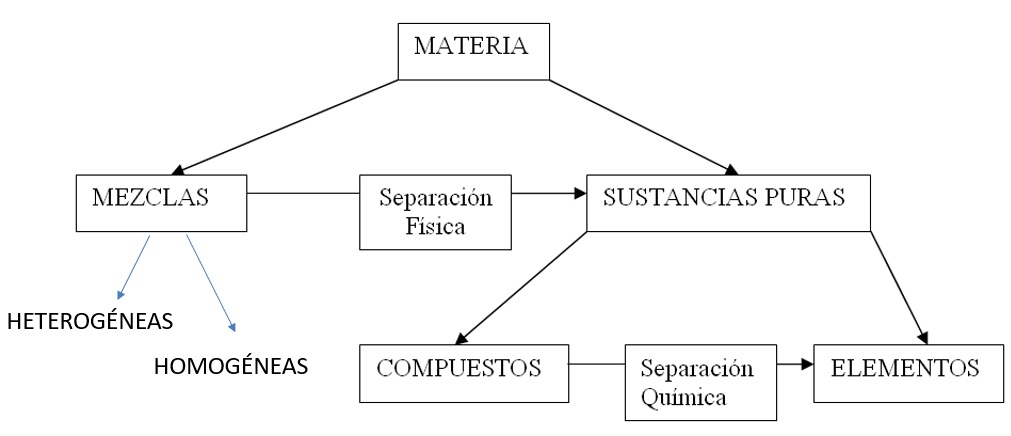
El siguiente esquema resume lo que hemos visto sobre sustancias químicas puras y mezclas.
¿Cuales de los materiales mostrados a continuación son mezclas heterogéneas? ¿mezclas homogéneas? ¿elementos? ¿compuestos?














Pruebe su acierto con HOT POTATOES
COMPRUEBE LO QUE HA APRENDIDO CON ESTA ACTIVIDAD DE LA WEB INICIACIÓN AL ESTUDIO DE LA MATERIA
¿ES LO MISMO UN COMPUESTO QUE UNA MEZCLA?
Si coloca en mismo recipiente arena y azúcar obtendrá una mezcla de ambos compuestos.
MEZCLA DE ARENA Y AZÚCAR
La proporción de cada uno de los ellos en la mezcla puede ser arbitraria. Habrá mezclas con más azúcar y mezclas con más arena. La mezcla no tiene una composición fija.
Los componentes están presentes en la mezcla sin sufrir ningún cambio. Si lo desea podrá apreciar que la mezcla de arena y azúcar es dulce.
Además los componentes de la mezcla pueden ser separados mediante un procedimiento sencillo (físico). En este caso bastaría añadir agua para provocar la disolución del azúcar y, posteriormente, fitrar. Este procedimiento tan sencillo es un ejemplo de separación física.
Si coloca en un mismo recipiente azufre e hierro obtendrá una mezcla de ambos elementos.
Sin embargo si la calienta fuertemente obtendrá un compuesto como consecuencia de una reacción química.
COMPUESTO DE HIERRO Y AZUFRE (SULFURO DE HIERRO II)
La composición del compuesto obtenido no es arbitraria, es una composición fija. Es decir, el azufre y el hierro se combinan en una determinada proporción para formar el sulfuro de hierro II. Por ello, si realiza esta experiencia, podrá observar que parte del hierro o del azufre que colocó al principio le ha quedado sin combinar.
Los componentes iniciales ya no están presentes en el producto final. Por ejemplo si acercamos un imán al sulfuro de hierro no observaremos ninguna atracción entre ambos.
La separación del sulfuro de hierro en azufre e hierro es muy difícil y exige nuevas reacciones químicas (separación química)
MEZCLA Y COMPUESTO (VIDEO)
LA EXISTENCIA DE ÁTOMOS AYUDA A ENTENDER EL CONCEPTO DE SUSTANCIA QUÍMICA PURA
LOS ELEMENTOS SON SUSTANCIAS PURAS QUE NO PUEDEN DESCOMPONERSE EN NADA MÁS SENCILLO. SUS PARTÍCULAS ESTÁN FORMADAS POR ÁTOMOS IDÉNTICOS.


LOS COMPUESTOS SON SUSTANCIAS PURAS QUE PUEDEN SEPARARSE EN AL MENOS DOS ELEMENTOS. SUS PARTÍCULAS ESTÁN FORMADAS POR AL MENOS DOS TIPOS DE ÁTOMOS.

¿QUÉ DIFERENCIAS EXISTEN ENTRE ELEMENTOS, COMPUESTOS Y MEZCLAS A NIVEL ATÓMICO?

Observe con atención los esquemas propuestos. Si los círculos representan átomos, ¿qué esquemas representan elementos? ¿y cuáles compuestos? ¿y cuáles mezclas?
Recuerde que en los elementos todos los átomos son iguales y que los compuestos están formados por partículas en las que se unen dos o más átomos diferentes. Recuerde también que las mezclas pueden serlo de dos elementos, de dos compuestos o de un elemento y un compuesto.







