|
||
CÉLULAS GALVÁNICAS PILAS |
||
Las células galvánicas, también denominadas células voltaicas o, simplemente, pilas o baterías, son dispositivos en los que una reacción espontánea es utilizada para producir corriente eléctrica.Una pila está formada por dos semicélulas (también llamadas electrodos) unidas entre sí por un puente salino y conectadas exteriormente por un circuito por el que se mueven los electrones (en la imagen, este circuito exterior contiene un voltímetro, pero podría contener una lámpara, un motor, ...).En esta pila "húmeda" (utilizada como recursos didáctico pero de escasa utilidad práctica) cada semicélula contiene una lámina de metal introducida en una disolución de una sal de ese metal. En suma, se busca que las formas reducida y oxidada de un par redox estén en contacto. En cada semicélula se produce una reacción redox, en una el proceso de oxidación (denominada ÁNODO) y en otra el de reducción (denominada CÁTODO). En este ejemplo (Pila Daniell), los electrodos son de cobre y zinc, como el cobre tiene un potencial estándar de reducción mayor que el zinc, en el electrodo de cobre se produce la reducción (Cátodo) y en el de zinc la oxidación (Ánodo): |
INDICE- Electroquímica, reacciones redox - Potencial estándar de reducción
|
|
TIPOS DE ELECTRODOSEn electroquímica son utilizados diferentes tipos de electrodos:1.- ELECTRODO METAL/ION METALUna lámina de un metal está sumergida en una disolución acuosa de una de sus sales
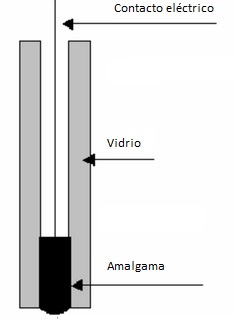
Cu | Cu2+ (aq)2.- ELETRODO DE AMALGAMAEl metal está formando una amalgama con mercurio (que no participa en el proceso redox)
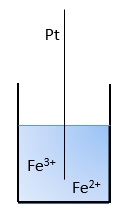
3.- ELECTRODO REDOXUn hilo inerte de platino está sumergido en una disolución que contiene un par redox (por ejemplo Fe2+ y Fe3+)
Pt | Fe3+,Fe2+4.- ELECTRODO METAL/SAL INSOLUBLEUn metal está en contacto con una de sus sales insolubles y con una disolución saturada de la sal que contiene una sal soluble con el mismo anión. El más famoso es el electrodo de calomelano.
Pt | Hg2Cl2 (s) | KCl (aq)5.- ELECTRODO DE GAS (ELECTRODO DE HIDRÓGENO)
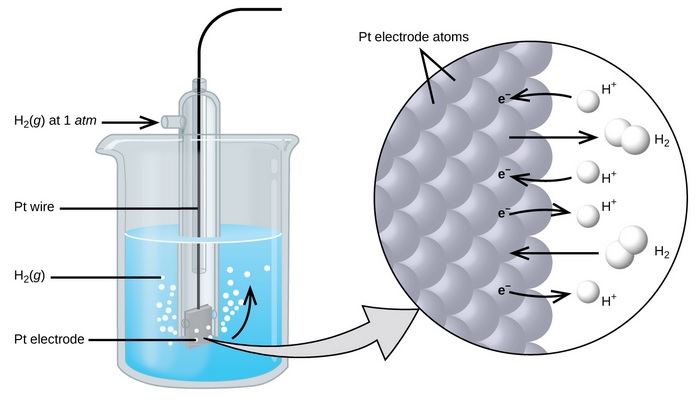
En un electrodo se debe asegurar el contacto íntimo entre las dos especies químicas que forman el par redox. En el caso del hidrógeno son H2 (forma reducida) y H+ (forma oxidada).El electrodo de hidrógeno está formado por un tubo en el que se introduce hidrógeno a 1 atm y que se sumerge en una disolución 1 M de ácido. Dentro del tubo hay un hilo conectado a una placa de platino. En ella tiene lugar el trasvase de electrones de la reacción redox. |
||
MEDIDA DEL POTENCIAL ESTÁNDAR DE REDUCCIÓNEn su momento indicamos que el potencial estándar de reducción PER de una especie química se mide en comparación con el del hidrógeno. No conocemos los valores absolutos de los PER, solo podemos medir sus valores relativos con respecto al hidrógeno. La medida experimental de esta magnitud implica la construcción de una pila en la que un electrodo contiene la especie química de la que queremos medir el PER y el otro electrodo es de hidrógeno.Esta simulación de la Universidad de Missouri-Rolla nos permite comprobar qué ocurre cuando construimos una pila en la que uno de los electrodos es de hidrógenoCuando conectamos un electrodo de cobre al de hidrógeno para construir una pila (en condiciones estándar) se observa que el hidrógeno se oxida, esto quiere decir que el electrodo de cobre tiene mayor PER que el hidrógeno, su valor será, por tanto, positivo. El valor concreto nos lo indica el voltímetro: 0,337 V.Cuando conectamos un electrodo de zinc al de hidrógeno para construir una pila, se observa que el hidrógeno se reduce, esto quiere decir que el electrodo de zinc tiene menor PER que el hidrógeno, su valor será, por tanto, negativo. El valor concreto nos lo indica el voltímetro; -0,763 V.En general, para determinar el valor del PER de una especie química, construimos una pila con ella y con hidrógeno. Si la especie química se reduce su PER será positivo, si se oxida será negativo. El valor absoluto del PER nos lo indica el voltímetro conectado a ambos electrodos. |
||
Diagramas de pilasEl diagrama de una pila indica las sustancias que intervienen en los dos electrodos que la forman. Por ejemplo, el siguiente diagrama hace referencia a una pila con dos electrodos del tipo metal/ion metálico, uno de magnesio y otro de plata. |
||
Volta
Alesandro Volta es el constructor de la primera pila (1800). Para ello apiló discos de cobre y zinc separados por una tela humedecida. La columna de discos terminaba en discos diferentes. Conectando un alambre a los dos discos extremos se producía corriente eléctrica (continua).Volta continuó los estudios de Galvani, que ya había observado que la pata de una rana sujeta por sus extremos con ganchos de distintos metales se contraía espasmódicamente.
|
||
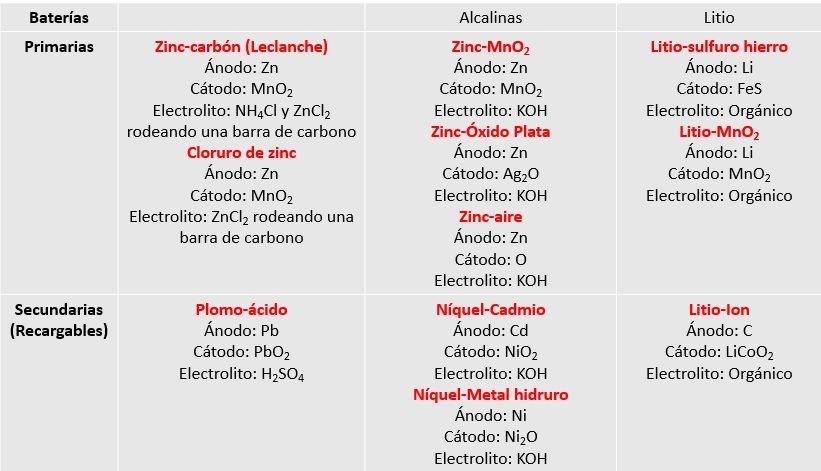
HISTORIA DE LAS PILASHabitualmente distinguimos entre las pilas primarias y las secundarias. Esta últimas (secundarias) pueden ser recargadas, las primarias no. Una relación de las principales pilas primarias y secundarias se expone en la siguiente figura
Los principales hitos en el desarrollo de las modernas baterías comerciales son los siguientes:1859: Baterías de plomo/ácidoGaston Plante creó la primera batería recargable: la batería de plomo/ácido. Posteriormente fueron perfeccionadas por Camile Faure incorporando placas de plomo y óxido de plomo.
1866: Pila LeclancheFue la primera batería seca. Es la batería carbón/zinc inventada por George Leclanche. Está compuesta de un ánodo de zinc con un cátodo de dióxido de manganeso colocado en un material poroso. La pila hace uso de una disolución de cloruro de amonio como electrolito. La incorporación de carbón al dióxido de manganeso del cátodo se mejoraba el tiempo de vida de la pila.En 1886 Carl Gassner mejoró la pila Leclanché. Le incorporó cloruro de zinc mejorando el tiempo de vida y alcanzando 1,5 V de potencial en la pila.
1899: Batería Níquel/CadmioWaldermar Jungner inventó la batería de níquel/cadmio. Es una batería recargable que contenía electrodos de níquel y cadmio humedecidos en una disolución de hidróxido de potasio. Es la primera batería que hace uso de un electrolito alcalino.
Las reacciones en los electrodos durante la descarga de la batería son las siguientes:
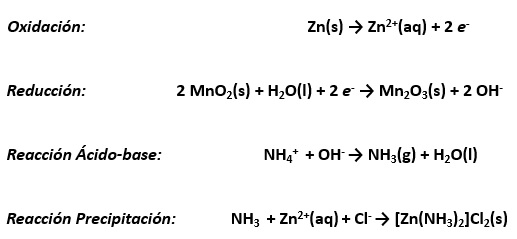
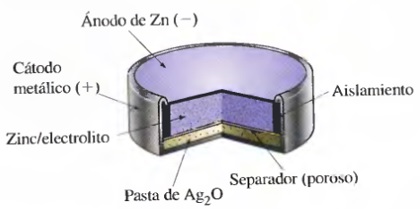
1942: Baterías botónSamuel Ruben (fundador de Duracell) inventó las pilas botón con mercurio a solicitud del ejército americano para ser aplicadas en aparatos en los que el tamaño de la pila fuera una variable relevante. Hoy día se siguen utilizando en relojes, cámaras fotográficas, etc.En esta pilas el ánodo es una amalgama de Zn-Hg y el cátodo puede estar formado por óxido de mercurio (II) HgO o por óxido de plata (Ag2O). En el primer caso (con HgO) la reacción en el cátodo y la reacción global de la pila son:
Ojo: se libera mercurioEn el caso que se utilice óxido de plata en lugar de óxido de mercurio, las reacciones en el cátodo y global son las siguientes:
Esta pilas tienen grandes limitaciones a causa de cuestiones medioambientales (Hg) y de precio (Ag).1955: Baterías alcalinasA mitad de la década de los 50 del siglo XX, un ingeniero de Eveready Battery Company llamado Lewis Urry, mejoró la vida de las pilas carbón/zinc (las únicas que se utilizaban por entonces) incorporándoles electrolitos alcalinos.
1991: Batería Litio-ionAunque se habían hecho intentos anteriormente, no fue hasta final del siglo XX cuando se comercializó la primera pila de litio. Hicieron falta tres avances muy importantes: el descubrimiento del cátodo de LiCoO2 por John Goodenough en 1980, el descubrimiento del ánodo de grafito por Rachid Yazami (1982) y el prototipo de batería de litio recargable de Asahi Chemical (Japón). Con todo ello, Sony comercializó la primera batería de litio en 1991.
En la descarga de la pila, los iones litio abandonan el ánodo de grafito y se unen al cátodo de LiCoO2.
Durante la carga, los iones litio recorren el camino inverso, abandonan el cátodo de LiCoO2 y se unen al ánodo de grafito.
Las reacciones químicas que ocurren en la pila son las siguientes:
|
||
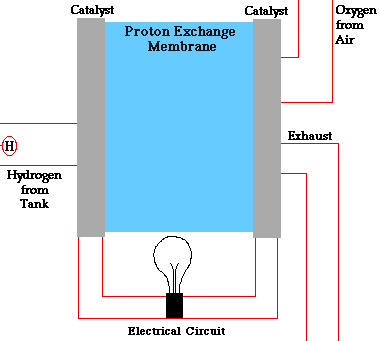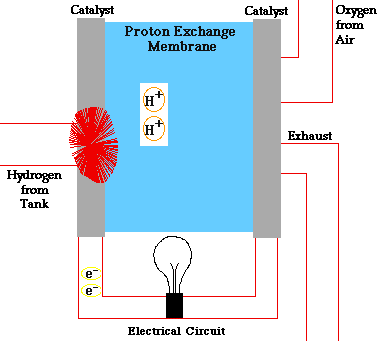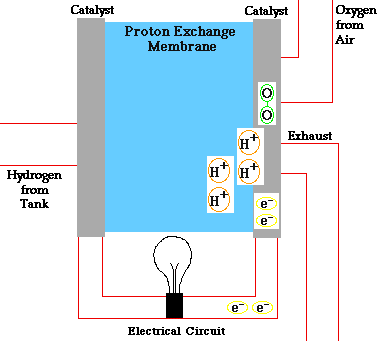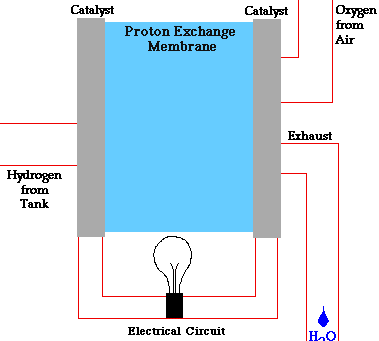
PILAS DE COMBUSTIBLE
En una pila de combustible como la de la figura, la reacción global que se produce es la combustión del hidrógeno, sin embargo, la energía liberada no se recoge en forma de calor sino en forma de energía eléctrica. Este hecho provoca que el rendimiento de este tipo de dispositivos sea muy alto (83 %).
Los tipos de pilas de combustible son los siguientes:ALCALINASEl electrolito suele ser una disolución acuosa de KOH. Eficiencia (cociente entre la variación de energía libre y la variación de entalpía) es del 70 %. Opera entre 150 y 200 ºC. Fueron usadas en el proyecto Apolo para proveer de electricidad y agua a los astronautas.
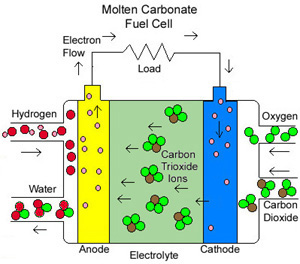
MCFC (DE CARBONATO FUNDIDO)Usa carbonato de sodio o de magnesio fundidos como electrolito. Eficiencia entre 60 y 80 %. Temperatura de operación muy alta, próxima a 650 ºC. Se han construido unidades de 2 Mw de potencia.
PAFC (DE ÁCIDO FOSFÓRICO)Usa ácido fosfórico como electrolito. Eficiencias entre 40 y 80 %. Temperatura de operación entre 150 y 200 ºC. Potencia hasta 11 Mw.
SOFC (DE ÓXIDO SÓLIDO)El electrolito es un compuesto cerámico de óxidos metálicos como calcio o zirconio. Eficiencia del 60 % y temperatura de trabajo próxima a 1000 ºC. Potencia típica 100 kw.
|