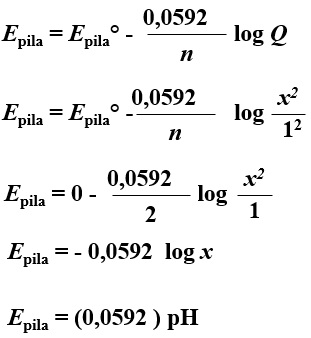|
 |
|
ECUACIÓN DE NERNST PILAS EN CONDICIONES NO ESTÁNDAR |
||
Hasta ahora hemos calculado el potencial de la pila en condiciones estándar. En este apartado aprenderemos a calcularla en otras condiciones, por ejemplo, cuando las concentraciones de las sustancias que intervienen son distintas a 1 M.Antes hemos visto que la variación de energía libre de un proceso en el que las sustancias que intervienen no están en condiciones estándar es: |
INDICE- Electroquímica, reacciones redox - Potencial estándar de reducción
|
|
EJEMPLO¿Cómo cambia el potencial de la pila formada por un electrodo de cobre y otro de zinc - pila Daniell - a medida que cambiamos sus concentraciones?La reacción espontánea que ocurre en esta pila es: |
||
PILAS DE CONCENTRACIÓNHasta ahora hemos subrayado la importancia de la naturaleza química de los electrodos en el potencial de la pila. De hecho en condiciones estándar solo hay que tener en cuenta los potenciales estándar de los electrodos (diferentes) para calcular su valor. Sin embargo, después de conocer la aportación de Nernst, deberíamos ampliar nuestro interés a otra variable: las concentraciones de las disoluciones iónicas presentes en los electrodos ya que, como vemos, también influyen en su potencial. ¿Se podría construir una pila con dos electrodos iguales en los que la única diferencia fuera la concentración de las disoluciones utilizadas?La respuesta es si. Con la siguiente simulación puede comprobarlo.Nosotros hemos utilizado dos electrodos de cobre. El de la izquierda tiene una concentración de iones cobre 0,001M y el de la derecha 1M. Como puede ver, al conectar la pila se mide una fuerza electromotriz de 0,09 V. Los electrones circulan de izquierda a derecha por el circuito exterior.El electrodo que esté sumergido en la disolución de mayor concentración tendrá mayor potencial.En el electrodo de la izquierda (baja concentración de iones cobre) se está produciendo la oxidación del cobre (es el ÁNODO). Los átomos de cobre de la lámina están perdiendo dos electrones y se están convirtiendo en iones de cobre que pasan a disolución aumentando su concentración. Esos dos electrones viajan por el circuito exterior hasta el otro electrodo. En el electrodo de la derecha (alta concentración de iones cobre) se está produciendo la reducción del cobre (es el CÁTODO). Los iones de la disolución están capturando electrones y se están transformando en átomos de cobre que se depositan en la lámina de cobre. El electrodo de cobre de la izquierda (ánodo) se disuelve y el de la derecha (cátodo) aumenta de masa.Por tanto, el origen de la diferencia de potencial en la pila es la diferencia de concentraciones en sus electrodos (PILA DE CONCENTRACIÓN). Esta pila, inicialmente, tendrá un potencial de 0,09 V que, a lo largo del tiempo, irá disminuyendo hasta anularse cuando las concentraciones de iones cobre en ambos electrodos sean iguales.
La ecuación de Nernst explica el potencial de la pila medido.Repita este cálculo usando la simulación con electrodos de plata o electrodos de zinc con diferentes concentraciones. |
||
APLICACIONES DE LAS PILAS DE CONCENTRACIÓNEn el ejemplo anterior hemos calculado el potencial de la pila a partir de las concentraciones (conocidas) de los iones en los electrodos. ¿Se podría hacer al contrario? ¿Se podría calcular la concentración de los iones en un electrodo si se conoce el potencial de la pila y la concentración de los iones en el otro electrodo?. La respuesta es si y, además, tiene aplicaciones muy interesantes como por ejemplo medir el pH de una disolución o medir la constante del producto de solubilidad de una sal poco soluble.1.- Medida del pH. Peachímetro.Supongamos una pila como la mostrada en la figura, en la que la concentración de iones hidronio del electrodo de la izquierda es desconocida, siendo 1M en el electrodo de la derecha.
Los electrones circulan por el circuito exterior desde el electrodo de la izquierda hasta el de la derecha. Por tanto, en el electrodo de la izquierda se está produciendo la oxidación (ÁNODO) y en el de la derecha se está produciendo la reducción (CÁTODO). |
||
POTENCIAL DE MEMBRANAEntre el interior y el exterior de una célula hay diferentes concentraciones de iones sodio, potasio y cloruro. Esto provoca que entre un lado y otro de la membrana plasmática haya una diferencia de potencial. Esta diferencia de potencial, conocida como potencial de membrana, se puede calcular en base a las concentraciones y permeabilidades iónicas.La ecuación de Nernst permite calcular el potencial de membrana para un ion. Sin embargo la ecuación de Goldman-Hodgkin-Katz permite hacerlo cuando participan dos iones positivos univalentes (K+ y Na+) y uno negativo univalente (Cl-).La siguiente simulación de la universidad de Arizona permite manejar las ecuaciones de Nernst y GHK en diferentes tipos de células. |