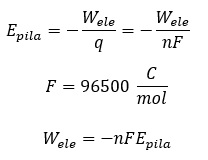|
||
ELECTROQUÍMICA Y TERMODINÁMICA |
||
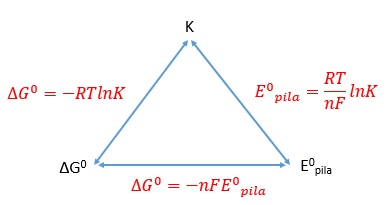
El potencial estándar de la pila está relacionado con la constante de equilibrio y la variación de energía libre de la reacción que tiene lugar en ella.
La relación entre la constante de equilibrio y la variación de energía libre ya fue estudiada en el tema dedicado al equilibrio químico. ¿Cuál es el origen de las otras dos relaciones en las que participa el potencial estándar de la pila?. |
INDICE- Electroquímica, reacciones redox - Potencial estándar de reducción
|
|
RELACIÓN ENTRE EL POTENCIAL ESTÁNDAR DE LA PILA Y LA VARIACIÓN DE ENERGÍA LIBRE¿Qué significado físico tiene el potencial estándar de la pila?.El potencial de la pila no es otra cosa que su fuerza electromotriz, es decir, el trabajo que realiza por unidad de carga que transporta entre sus polos. Por otra parte, hay que tener en cuenta dos cuestiones: ese trabajo es negativo porque sale del sistema y, además, la carga transportada se puede poner como producto del número de moles de electrones transportados por el Faraday (carga eléctrica de un mol de electrones)
Ahora solo falta recordar que el la energía libre es la energía disponible para hacer trabajo. Por tanto, la variación de la energía libre no es otra cosa que el trabajo máximo que puede realizar un sistema. En este caso ese trabajo es el trabajo eléctrico de la pila. En consecuencia: |
||
RELACIÓN ENTRE EL POTENCIAL ESTÁNDAR DE LA PILA Y LA CONSTANTE DE EQUILIBRIOConocemos dos ecuaciones que relacionan la variación de energía libre con la constante de equilibrio y el potencial de la pila. Entre ellas podemos obtener la relación que buscamos:
Teniendo en cuenta que en condiciones estándar la temperatura es 298 K y que el valor de la constante de los gases es R = 8,314 J/Kmol, podemos expresar la ecuación anterior de otra forma: |
||
CÁLCULO DE POTENCIALES DE ELECTRODO A PARTIR DE OTROS CONOCIDOS
Como se puede comprobar, aunque la suma de las dos reacciones permite obtener la reacción problema, no debemos sumar los potenciales estándar porque se refieren a cantidades de electrones diferentes. Lo que hay que hacer es determinar la variación de energía libre que acompaña a cada uno de los dos procesos y, aquí si, sumarlas. Una vez calculada la variación de energía libre asociada a la reacción problema, se calcula su potencial estándar. |