|
||
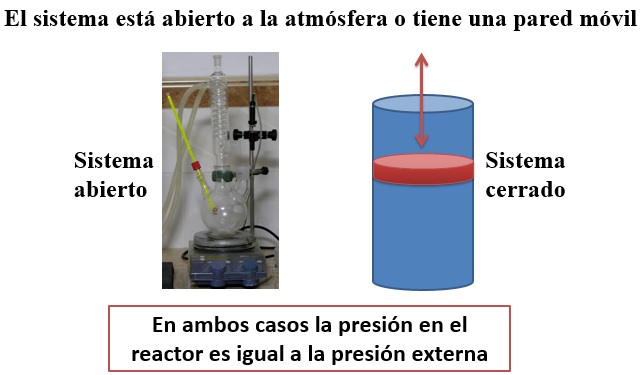
CALOR INTERCAMBIADO EN PROCESOS A VOLUMEN O PRESIÓN CONSTANTES |
||
El estudio del calor intercambiado en procesos a volumen o presión constantes es especialmente importante en la Termoquímica. No hay que olvidar que las reacciones químicas suelen ocurrir a presión constante (presión atmosférica) y que en dispositivos tan utilizados como la bomba calorimétrica las reacciones ocurren a volumen constante. |
INDICE- Primer Principio Termodinámica - Calor a volumen y a presión constantes - Entalpía estándar de reacción - Máquinas térmicas. Ciclo Carnot - Entropía. Segundo Principio Termodinámica - Entropía absoluta. Tercer Principio de la Termodinámica - Espontaneidad reacciones químicas. Entropía - Espontaneidad reacciones químicas. Energía Libre Gibbs |
|
La cantidad de calor que intercambia una reacción química depende de las condiciones experimentales en que se realice (P = cte ; o V = cte).Veamos un ejemplo
Imaginemos que cogemos un mol de metano (gas) y dos de dioxígeno (gas) y los colocamos en un recipiente a P=1 atm y T =298 K. A continuación hacemos saltar una chispa eléctrica y se produce la combustión (explosiva) del metano. A nivel químico los reactivos se convertirán en un mol de dióxido de carbono (gas) y dos moles de agua (líquido en condiciones estándar). A nivel energético la reacción (exotérmica) liberará energía que calentará el sistema (aumentará la presión y la temperatura). Nosotros esperaremos hasta que el sistema baje la temperatura y vuelva a tener las condiciones que tenía inicialmente P=1 atm y T =298 K. ¿Se liberará la misma cantidad de energía si el sistema mantiene P = cte que si mantiene V = cte?. No. Si el sistema no cambia de volumen (paredes rígidas como en la bomba calorimétrica) toda la liberación de energía que produce la reacción química se convierte en el calor que ha de atravesar las paredes del sistema para que la temperatura pueda bajar hasta 298 K. Sin embargo, si el sistema tiene una pared móvil que mantenga la presión constante hay que tener en cuenta el trabajo. ¿Por qué?. Hay que tener cuenta que en los reactivos había tres moles de gases, sin embargo, en los productos solo hay uno (el de CO2 ya que los dos moles de agua están en estado líquido a P=1 atm y T =298 K). Por tanto, para que al final el sistema se encuentre a la misma presión que al principio, la pared móvil debe reducir su volumen. Dicho de otro modo, el entorno ha de hacer trabajo sobre el sistema. Por lo tanto, si el sistema tiene los mismos estados inicial y final en ambas transformaciones (a V cte y a P cte), la variación de energía interna debe ser la misma en ambos casos.∆U = Qv∆U = Qp + WEsto nos obliga a aceptar que Qv = Qp + W. O sea que, en general, los calores liberados por una reacción a volumen y a presión constantes no son iguales. |
||
CALOR EN UN PROCESO A VOLUMEN CONSTANTE
Si V= constante, W = 0
Lo hemos visto en el ejemplo anterior de la combustión de un mol de metano. Si no cambia el volumen del sistema, todo el cambio de energía interna que experimenta el sistema ha de atravesar sus paredes en forma de calor. |
||
CALOR EN UN PROCESO A PRESIÓN CONSTANTE
Como vimos en el ejemplo de combustión del metano, el calor intercambiado por el sistema a presión constante no coincide con el cambio de energía interna, la diferencia es el trabajo realizado. En este caso, sin embargo, podemos definir la entalpía. Cuando la presión es constante, el calor intercambiado coincide con el cambio de entalpía. |
||
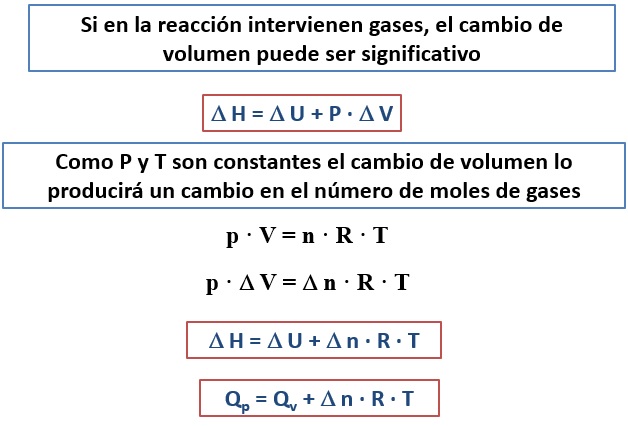
Tal como se ha definido, la entalpía es una función de estado que no mide la energía del sistema. La energía del sistema es la energía interna, la entalpía es una función de estado útil porque su variación coincide con el calor intercambiado a presión constante.H = U + P·VLa entalpía se mide en julios y, al igual que la energía interna, no puede calcularse su valor absoluto sino sus variaciones. |
||
RELACIÓN ENTRE LOS CALORES A VOLUMEN Y PRESIÓN CONSTANTES
La diferencia entre los calores a presión y volumen constantes está relacionada con el cambio del número de moles de gases que tenga lugar en el proceso. Si en reactivos y productos hay el mismo número de moles de gases los calores intercambiados a presión y volumen constantes son iguales. |