|
 |
|
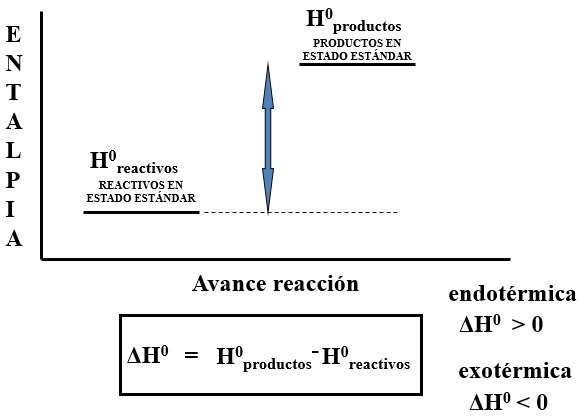
ENTALPÍA ESTÁNDAR DE REACCIÓN |
||
Conocida como calor de reacción a presión constante. Es la variación de entalpía que tiene lugar en una reacción química cundo los reactivos en condiciones estándar se transforman en los productos en condiciones estándar (p = 1 atm; T = 298 K; conc. = 1 M)
|
INDICE- Primer Principio Termodinámica - Calor a volumen y a presión constantes - Entalpía estándar de reacción - Máquinas térmicas. Ciclo Carnot - Entropía. Segundo Principio Termodinámica - Entropía absoluta. Tercer Principio de la Termodinámica - Espontaneidad reacciones químicas. Entropía - Espontaneidad reacciones químicas. Energía Libre Gibbs |
|
ECUACIONES TERMOQUÍMICAS |
||
LEY DE HESS
Esta ley es consecuencia de que la entalpía es una función de estado. Sus cambios solo dependen de los estados inicial y final (no del proceso). |
||
MÉTODOS DE CÁLCULO DE LA ENTALPÍA ESTÁNDAR DE REACCIÓN
|
||
MÉTODO 1: COMBINACIÓN DE ECUACIONES TERMOQUÍMICAS
Se puede comprobar que sumando las dos ecuaciones termoquímicas "datos" se obtiene la ecuación química "problema"
|
||
ENTALPÍA ESTÁNDAR DE COMBUSTIÓNVariación de entalpía que se produce en la combustión de un mol de una sustancia cuando reactivos y productos se encuentran en estado estándar.
Son fáciles de determinar y se encuentran tabuladas en los libros de Química, por ello son muy usadas como datos cuando hacemos uso del método 1 en el cálculo de entalpías de reacción.
|
||
MÉTODO 2: USO DE ENTALPÍAS DE FORMACIÓNEl uso de entalpías de formación permite calcular entalpías de reacción
POR EJEMPLO:
|
||
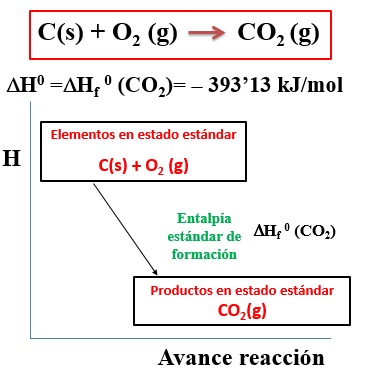
ENTALPÍA ESTÁNDAR DE FORMACIÓNLa entalpía estándar de formación es la variación de entalpía que acompaña a la formación de un mol de una sustancia en estado estándar a partir de sus elementos en estado estándar.
La entalpía estándar de formación del formaldehido es -108,6 kJ/mol porque cuando se forma un mol de esa sustancia en estado estándar a partir de sus elementos en estado estándar se libera esa cantidad de energía.
La entalpía estándar de formación del dióxido de carbono es -393,13 kJ/mol porque cuando se forma un mol de esa sustancia en estado estándar a partir de sus elementos también en estado estándar se liberan 393,13 kJ de energía.
Las entalpías de formación están tabuladas
|
||
MÉTODO 3: USO DE ENERGÍAS DE ENLACEEl uso de energías de enlace permite calcular entalpías de reacción
|
||
ENERGÍA DE ENLACE
|