ESTEREOISOMERÍA CONFIGURACIONAL
ISOMERÍA ÓPTICA
Se produce por una falta de simetría en la molécula provocada por la presencia de uno o varios estereocentros que, en general, son carbonos asimétricos (quirales), es decir, átomos de carbono con hibridación sp3 unidos a cuatro sustituyentes diferentes
¿POR QUÉ SE LES DENOMINA ISÓMEROS ÓPTICOS?
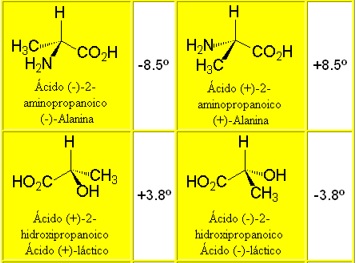
LOS ISÓMEROS ÓPTICOS SON SUSTANCIAS IDÉNTICAS EN TODAS LA PROPIEDADES FÍSICAS SALVO EN UNA: LA ROTACIÓN DEL PLANO DE POLARIZACIÓN DE LA LUZ (SON ÓPTICAMENTE ACTIVOS)


Los isómeros ópticos se manifiestan por parejas. Si uno de ellos rota el plano de polarización de la luz hacia la derecha (dextrógiro) un cierto número de grados, el otro hace lo mismo, en la misma cuantía, pero hacia la izquierda (levógiro).
En la naturaleza todas las proteínas son levógiras y los carbohidratos dextrógiros
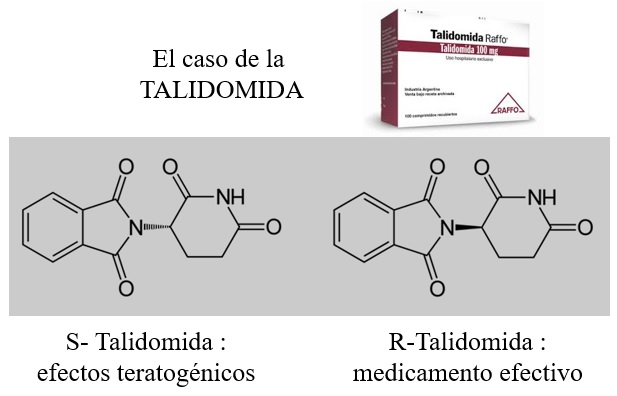
LOS ISÓMEROS ÓPTICOS SON IDÉNTICOS EN TODAS LAS PROPIEDADES QUÍMICAS SALVO CUANDO LOS ENFRENTAMOS A OTRAS SUSTANCIAS ÓPTICAMENTE ACTIVAS. ESO PUEDE DAR LUGAR A COMPORTAMIENTOS MUY DIFERENTES (CASO DE LA TALIDOMIDA)
ESTEREOQUÍMICA: ORIGEN DEL PROBLEMA
CONFORMACIONES DEL CICLOHEXANO
ESTEREOISOMERIA CONFIGURACIONAL. ISOMERÍA GEOMÉTRICA
ESTEREOISOMERÍA CONFIGURACIONAL. ISOMERÍA ÓPTICA
REPRESENTACIÓN DE MOLÉCULAS EN 3-D
QUIRALIDAD SIN CENTROS QUIRALES
IDENTIFICACIÓN DE CARBONOS QUIRALES
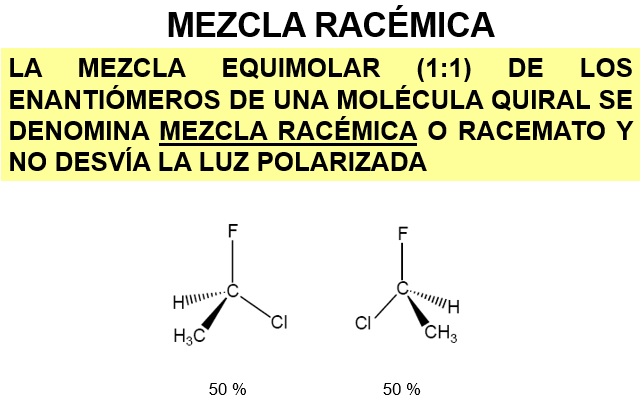
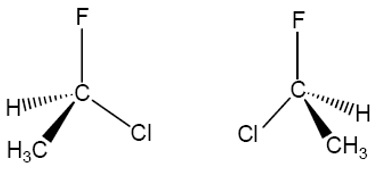
El 1-cloro-1-fluoroetano presenta isomería óptica porque el C1 es un estereocentro. Este carbono es quiral porque está unido a cuatro sustituyentes diferentes. Hay dos sustancias diferentes que esponden a esa fórmula molecular.
Puede comprobar que esta molécula y su imagen especular no son superponibles. Forman una pareja de enantiómeros.
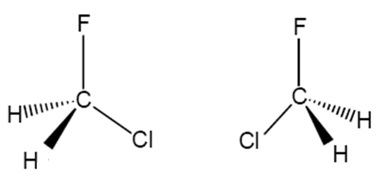
El clorofluorometano no presenta isomería óptica. El átomo de carbono no es quiral (está unido a dos átomos de H). Solo hay una sustancia que responda a esta fórmula molecular.
Esta molécula y su imagen especular son superponibles, es decir, son idénticas.
¿CUÁNTOS ISÓMEROS ÓPTICOS PUEDE TENER UNA SUSTANCIA?
El número de isómeros ópticos de una especia química depende del número de carbonos asimétricos que posea su molécula. Como regla general pordemos decir que el NÚMERO MÁXIMO de isómeros ópticos es 2n, siendo n el número de esterocentros. Indicamos que ese número es máximo porque puede verse reducido si la molécula presenta algún plano de simetría.
En el caso del butan-2-ol hay un solo estereocentro, por tanto, existirán dos isómeros ópticos de esta sustancia: (R)-Butan-2-ol y (S)-Butan-2-ol. A esta pareja de sustancias se les denomina ENANTIÓMEROS: sus moléculas son imágenes especulares no superponibles (compruébelo con los siguientes modelos)
(R)-Butan-2-ol
(S)-Butan-2-ol
¿QUÉ OCURRE CUANDO UNA MOLÉCULA PRESENTA MÁS DE UN CARBONO ASIMÉTRICO?
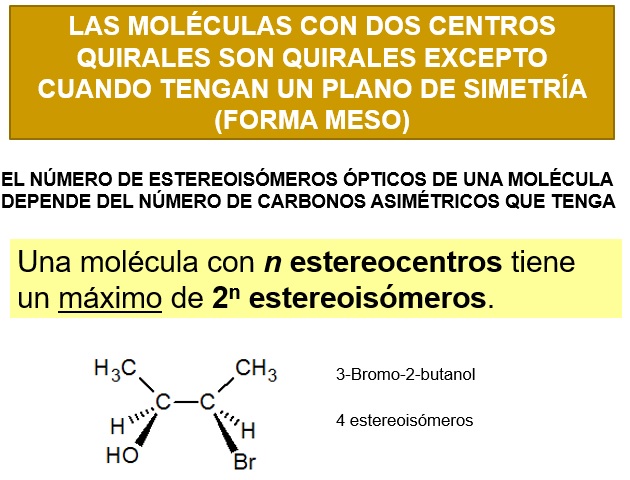
Para realizar el estudio de los isómeros ópticos se suelen usar PROYECCIONES de FISCHER
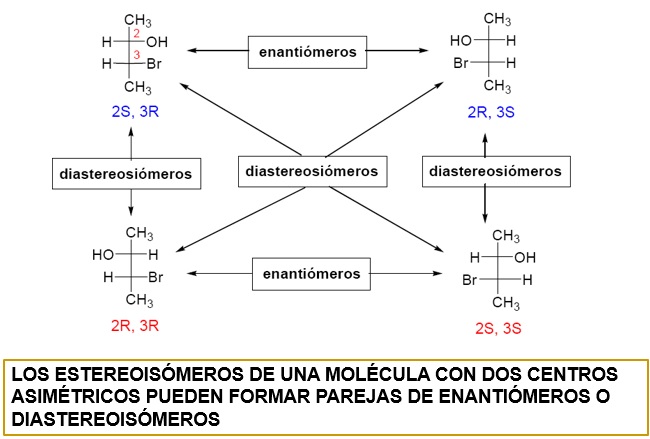
Como se ha indicado, los enantiómeros son especies químicas muy parecidas en prácticamente todas las propiedades. Eso no ocurre entre los diastereoisómeros. Estas son sustancias diferentes en muchas propiedades y pueden ser separadas con mayor facilidad que los enantiómeros.
(S,R)-2-bromo-3-clorobutano
(S,R)-2-bromo-3-clorobutano
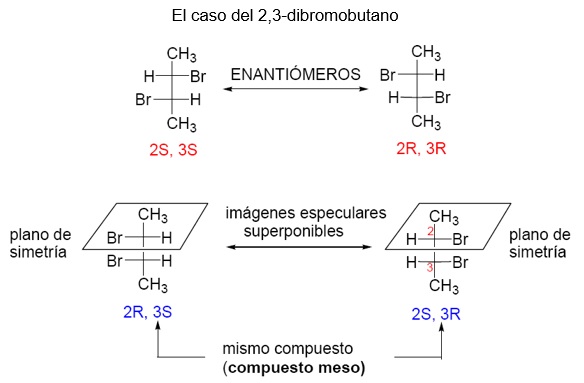
COMPUESTO MESO
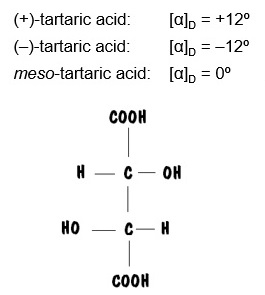
Pero la regla general acerca del número de estereoisómeros no siempre se cumple. Cuando la molécula con más de un estereocentro presenta simetría, el número de estereoisómeros disminuye, produciéndose especies que no son ópticamente activas denominadas formas MESO. Es el caso, por ejemplo, del ácido tartárico (ácido 2,3-dihidroxibutanodioico)
Pasteur, analizando las formas de los cristales de tartrato, pudo separar tres isómeros de esta sustancia. Dos de ellos presentaban actividad óptica y fundían a 170 ºC (eran, evidentemente, una pareja de enantiómeros). El tercero no presentaba actividad óptica y fundía a 148 ºC.
El análisis de la PROYECCIONES de FISCHER de estas moléculas explica lo que ocurre.
Los isómeros R,R y S,S presentan actividad óptica porque sus moléculas son imágenes especulares no superponibles. Forman una pareja de enantiómeros.
Los isómeros R,S y S,R tienen moléculas que son imágenes especulares SUPERPONIBLES. Es decir, no son sustancias diferentes sino la misma. Esto ocurre porque en este caso la molécula de ácido tartárico presenta un plano de simetría (fíjese que en la proyección de Fischer la mitad superior y la inferior son idénticas). Se trata de la forma MESO del ácido tartárico.
Importante: la forma MESO no desvía el plano de polarización de la luz porque sus moléculas son simétricas y no pueden hacerlo. Es algo muy diferente a la mezcla racémica.
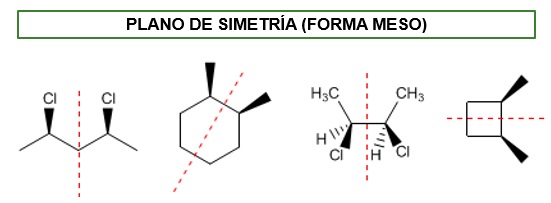
PROPIEDADES DE LA FORMA MESO EN COMPUESTOS CON DOS CENTROS QUIRALES:
-ES ÓPTICAMENTE INACTIVA
-DEBE SER DE LA FORMA (R,S)
-ES DIASTEREÓMERO DE LOS ISÓMEROS (R,R) Y (S,S)
2,3-diclorobutano